题目内容
【题目】砷和镍是重要的材料和化工领域用途广泛。请回答下列问题:
(1)基态As原子中,价电子的电子云轮廓图形状为___。与砷同周期的主族元素的基态原子中,电负性最大的为____(填元素符号)。
(2)![]() 可用于碘的微量分析。
可用于碘的微量分析。
①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为_______。
②其中阴离子的VSEPR模型为_____,与其互为等电子体的分子为_____(只写一种分子式即可)。
(3)M(![]() )可用于合成Ni2+的配体,M中C原子的杂化形式为______,σ键和π键的数目之比为_____。
)可用于合成Ni2+的配体,M中C原子的杂化形式为______,σ键和π键的数目之比为_____。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为______。区分晶体Ni和非晶体Ni的最可靠的科学方法为_______。
(5)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为![]() ,该晶体的密度ρ=____g·cm-3。
,该晶体的密度ρ=____g·cm-3。

【答案】球形、哑铃型或纺锤形 Br 电子从较高能级的激发态跃迁到低能级的激发态乃至基态时,会以光的形式释放能量 三角锥形 PCl3、PBr3、NF3、NCl3等 sp3、sp2 7:1 Ni的原子半径较小,价层电子数目多,金属键较强 X-射线衍射法 ![]()
【解析】
(1)基态As原子的价电子排布式为4s24p3,故其电子云轮廓图形状为球形、哑铃型或纺锤形。一般情况下,同周期的主族元素从左到右,元素的电负性逐渐增大,所以与砷同周期的主族元素的基态原子中,电负性最大的为Br,故答案为:球形、哑铃型或纺锤形,Br。
(2)①金属元素能产生焰色反应的微观原因为电子从较高能级的激发态跃迁到低能级的激发态乃至基态时,会以光的形式释放能量,产生焰色反应,故答案为:电子从较高能级的激发态跃迁到低能级的激发态乃至基态时,会以光的形式释放能量。
②AsO33-中As原子的价层电子对数目为4,其立体构型为三角锥形,根据等电子体的含义可知,与AsO33-互为等电子体的分子有PCl3、PBr3、NF3、NCl3等,故答案为:三角锥形,PCl3、PBr3、NF3、NCl3等。
(3)由![]() 的结构简式可知,—CH3、—CH2—、—CF3中的C原子的价层电子对数目为4,杂化方式为sp3,碳氧双键中C原子的价层电子对数目为3,杂化方式为sp2,每个
的结构简式可知,—CH3、—CH2—、—CF3中的C原子的价层电子对数目为4,杂化方式为sp3,碳氧双键中C原子的价层电子对数目为3,杂化方式为sp2,每个![]() 分子中含有14个σ键和2个π键,则σ键和π键的数目之比为7:1,故答案为:sp3、sp2,7:1。
分子中含有14个σ键和2个π键,则σ键和π键的数目之比为7:1,故答案为:sp3、sp2,7:1。
(4)金属晶体熔沸点的高低与金属键的强弱有关,金属键的强弱与价层电子数目和金属原子的半径有关,所以金属Ni的熔点和沸点都比金属Ca高的原因为Ni的原子半径较小,价层电子数目多,金属键较强。区分晶体Ni和非晶体Ni的最可靠的科学方法为为X-射线衍射法,故答案为:Ni的原子半径较小,价层电子数目多,金属键较强;X-射线衍射法。
(5)由晶胞结构可知,每个晶胞中含有2个Ni原子和2个As原子,晶胞的体积V=![]() cm3,故晶胞的密度
cm3,故晶胞的密度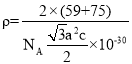 g/cm3=
g/cm3=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案