题目内容
19.下列实验操作正确的是( )| A. |  滴加液体 | B. |  取用固体 | C. | 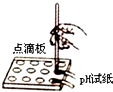 测溶液pH | D. |  过滤 |
分析 A.滴加液体时,滴定管应该悬空,不能接触试管;
B.取药品时,瓶盖应该倒扣在桌面上;
C.用pH试纸测量液体的pH值时,先把pH试纸放在点滴板上,再用胶头滴管吸取待测液滴到pH试纸,与标准比色卡对照,读数即可;
D.过滤时,要用玻璃棒引流,且漏斗低端要紧靠烧杯内壁.
解答 解:A.滴加液体时,滴定管应该悬空,不能接触试管,否则会污染药品,故A错误;
B.取药品时,瓶盖应该倒扣在桌面上,根据图知该操作错误,故B错误;
C.用pH试纸测量液体的pH值时,先把pH试纸放在点滴板上,再用胶头滴管吸取待测液滴到pH试纸,与标准比色卡对照,读数即可,操作正确,故C正确;
D.过滤时,要用玻璃棒引流,且漏斗低端要紧靠烧杯内壁,所以操作错误,故D错误;
故选C.
点评 本题考查化学实验方案评价,侧重考查基本操作,为高频考点,明确操作规范性是解本题关键,易错选项是A,注意:制取氢氧化亚铁沉淀时胶头滴管必须伸入液面下.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.如表陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+有氧化性 | 实验室常用KSCN溶液检验Fe3+ |
| B | SO2有较强的还原性 | SO2可使酸性KMnO4溶液褪色 |
| C | 浓硫酸可干燥NO和SO2 | NO和SO2还原性都弱 |
| D | 浓硫酸有吸水性 | 浓硫酸可用于干燥氨气 |
| A. | A | B. | B | C. | C | D. | D |
7.25℃时,电离平衡常数:
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是:cd
a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH═CH3COO-+HClO
c.CO32-+HClO═CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O═CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B
A.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ B.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
C.$\frac{c({H}^{+})}{{K}_{W}}$ D.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化 如图甲,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)

(5)向20mL硫酸和盐酸的混合溶液中,逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图乙所示.计算:
①原混合溶液中c(H+)=0.3mol/L;c(Cl-)=0.2mol/L.
②A点的pH=1.
③将0.15mol•L-1稀硫酸V1mL与0.1mol•L-1NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是:cd
a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH═CH3COO-+HClO
c.CO32-+HClO═CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O═CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B
A.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ B.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
C.$\frac{c({H}^{+})}{{K}_{W}}$ D.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化 如图甲,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)

(5)向20mL硫酸和盐酸的混合溶液中,逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图乙所示.计算:
①原混合溶液中c(H+)=0.3mol/L;c(Cl-)=0.2mol/L.
②A点的pH=1.
③将0.15mol•L-1稀硫酸V1mL与0.1mol•L-1NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
14.某温度下,在体积一定的密闭容器中投入反应物达到平衡,已知反应方程式为mX(g)+nY(g)?qZ(g)△H>0,m+n>q,下列叙述正确的是( )
| A. | 通惰性气体增大压强,平衡正向移动 | |
| B. | 再加入X,反应吸收的热量增大 | |
| C. | 增加Y的物质的量,X的转化率减小 | |
| D. | 降低温度,c(Y):c(Z)的值变小 |
11.在密闭容器中的一定量混和气体发生反应:mA(g)+nB(g)?pC(g),平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积缩小到原来的1/2时,达到新的平衡时,测得A的浓度为0.8mol/L.下列有关判断正确的是( )
| A. | m+n<p | B. | C的体积分数下降 | ||
| C. | 平衡向逆反应反向移动 | D. | A的转化率变大 |
9.下列说法正确的是( )
| A. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| D. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g 氧气,转移2NA个电子 |
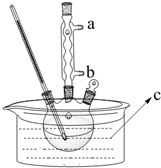 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为: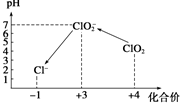 ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.