题目内容
7.25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是:cd
a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH═CH3COO-+HClO
c.CO32-+HClO═CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O═CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B
A.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ B.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
C.$\frac{c({H}^{+})}{{K}_{W}}$ D.$\frac{c({H}^{+})}{c(O{H}^{-})}$
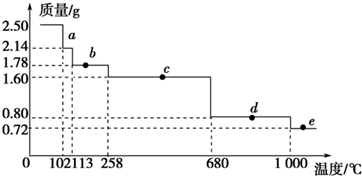
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化 如图甲,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)

(5)向20mL硫酸和盐酸的混合溶液中,逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图乙所示.计算:
①原混合溶液中c(H+)=0.3mol/L;c(Cl-)=0.2mol/L.
②A点的pH=1.
③将0.15mol•L-1稀硫酸V1mL与0.1mol•L-1NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
分析 (1)酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱;
(2)酸性强弱为CH3COOH>H2CO3>HClO>HCO3-,强酸能够制取弱酸,据此对各选项进行判断;
(3)醋酸是弱电解质,加水稀释醋酸,促进醋酸电离,则n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,但醋酸根离子、氢离子浓度增大的程度小于溶液体积增大的程度,所以c(CH3COO-)、c(H+)、c(CH3COOH)都减小,据此分析解答;
(4)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大;
(5)①根据图象知,当混合溶液pH=7时,说明酸中氢离子和碱中氢氧根离子的物质的量相等,据此计算氢离子浓度;
当20mL时硫酸和氢氧化钡恰好反应生成硫酸钡,据此计算硫酸根离子浓度,结合电荷守恒计算氯离子浓度;
③根据A点溶液中氢离子浓度计算溶液的pH;
③pH=1的混合溶液中c(H+)=0.1mol/L,混合溶液中c(H+)=$\frac{0.15×2×{V}_{1}-0.1×{V}_{2}}{{V}_{1}+{V}_{2}}$mol/L,据此计算V1:V2.
解答 解:(1)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO->HCO3->CH3COO-,即a>b>d>c,
故答案为:a>b>d>c;
(2)a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O:碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;
b.ClO-+CH3COOH═CH3COO-+HClO:CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;
c.CO32-+HClO═CO2↑+H2O+ClO-:HClO的酸性小于碳酸,该反应无法发生,故c正确;
d.2ClO-+CO2+H2O═CO32-+2HClO:由于酸性H2CO3>HClO>HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;
故答案为:c、d;
(3)A.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的比值减小,故A错误;
B.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值增大,故B正确;
C.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以$\frac{c({H}^{+})}{{K}_{W}}$的比值减小,故C错误;
D.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,$\frac{c({H}^{+})}{c(O{H}^{-})}$的比值减小,故D错误;
故答案为:B;
(4)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大,
根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数,稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+),
故答案为:大于;大于;
(5)①由图象知,当pH=7时,消耗Ba(OH)2溶液体积为60mL,由于n(H+)=n(OH-),得c(H+)=0.05mol/L×0.06L×2÷0.02L=0.3 mol•L-1;
当加入20mLBa(OH)2溶液时,硫酸根离子完全反应,根据原子守恒得c(SO4 2-)=c(H2SP4)=0.05mol/L×0.02L/0.02L=0.05mol/L,
溶液呈电中性,根据电荷守恒得c(Cl-)+2c(SO4 2- )=c(H+),c(Cl-)=c(H+)-2c(SO4 2- )=0.3 mol•L-1-2×0.05mol/L=0.2 mol•L-1,
故答案为:0.3mol•L-1;0.2mol•L-1;
②A点c(H+)=0.3mol/L×0.02L-2×0.05mol/L×0.02L/0.04L=0.1mol/L,所以pH=1,
故答案为:1;
③pH=1的混合溶液中c(H+)=0.1mol/L,混合溶液中c(H+)=$\frac{0.15×2×{V}_{1}-0.1×{V}_{2}}{{V}_{1}+{V}_{2}}$mol/L=0.1mol/L,整理可得:V1:V2=1:1,
故答案为:1:1.
点评 本题考查酸碱混合溶液定性判断,为高频考点,题目难度中等,涉及离子浓度大小比较、pH的简单计算等知识,试题知识点较多、综合性较强,充分考查学生分析判断能力及化学计算能力.

 发散思维新课堂系列答案
发散思维新课堂系列答案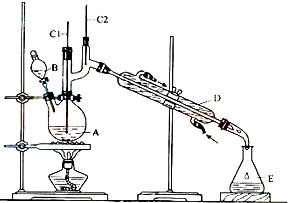
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,容易发生迸溅.
(2)加入沸石的作用是防止暴沸.
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(7)本实验中,正丁醛的产率为51.4%.

在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(3)能使该反应的反应速率增大是bcd.
| A. |  滴加液体 | B. |  取用固体 | C. |  测溶液pH | D. |  过滤 |