题目内容
4. ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有氧化性.
(2)工业上可用 Cl2氧化 NaClO2溶液制取 ClO2,该反应的化学方程式为Cl2+2NaClO2=2NaCl+2ClO2.工业上还可在80℃时电解氯化钠溶液得到 NaClO3,然后与盐酸反应得到ClO2.电解时,NaClO3在(填阴或阳)阳极生成,生成ClO3-的电极反应式为Cl--6e-+3 H2O=6H++ClO3-.
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg/L之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液.(已知:2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I-)
Ⅲ.加硫酸调节水样pH至1~3.
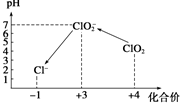
操作时,不同pH环境中粒子种类如图所示:
请回答:
①操作Ⅰ中反应的离子方程式是2ClO2+2I-=2ClO2-+I2.
②确定操作Ⅱ完全反应的现象是蓝色消失,半分钟内不变色.
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是ClO2-+4I-+4H+=Cl-+2I2+2H2O.
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3 mol/L的Na2S2O3溶液10mL,则水样中ClO2的浓度是0.675mg/L.
分析 (1)氧化还原反应中化合价升降相等,判断ClO2中Cl元素化合价变化,元素化合价升高表现还原性,元素化合价降低表现氧化性,以此解答;
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,结合原则守恒和电子守恒写出该反应的化学方程,工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,氯离子失电子在阳极生成氯酸根离子;
(3)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2与淀粉结合再次出现蓝色,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
④根据关系S2O32-~I-~ClO2先计算出ClO2的物质的量,然后再计算出浓度.
解答 解:(1)反应中Fe元素、Mn元素化合价升高,根据化合价升降相等,ClO2中Cl元素化合价降低,表现氧化性,故答案为:氧化;
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,结合原则守恒和电子守恒写出该反应的化学方程Cl2+2NaClO2=2NaCl+2ClO2,工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,氯离子失电子在阳极生成氯酸根离子,电极反应为:Cl--6e-+3 H2O=6H++ClO3-,
故答案为:Cl2+2NaClO2=2NaCl+2ClO2;阳; Cl--6e-+3 H2O=6H++ClO3-;
(3)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2+2I-=2ClO2-+I2,故答案为:2ClO2+2I-=2ClO2-+I2.
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-,故蓝色会消失,故答案为:蓝色消失,半分钟内不变色.
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O,故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④S2O32-~~I-~~ClO2
1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样为 1L,所以 ClO2 的浓度为$\frac{0.675mg}{1L}$=0.675 mg•L-1
故答案为:0.675.
点评 本题主要考查了氧化还原反应、离子方程式式的书写以及化学计算,掌握物质性质和化学基础是解题的关键,题目难度中等.

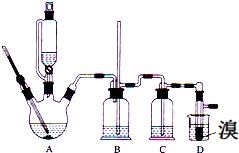 实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的两步反应方程式为C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br.
(2)在此实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰
水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.

在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(3)能使该反应的反应速率增大是bcd.
| A. |  滴加液体 | B. |  取用固体 | C. |  测溶液pH | D. |  过滤 |
| A. | 相同时间内消耗n mol N2的同时消耗3n mol H2 | |
| B. | H2的体积分数不再发生变化 | |
| C. | 容器内原子总数不再发生变化 | |
| D. | 容器内气体的密度不再发生变化 |
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是c、e(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.
此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol•L-1;该时间内反应速率v(CH3OH)=0.16mol/(L•min).