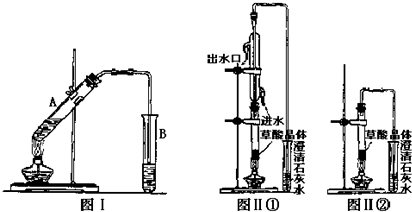
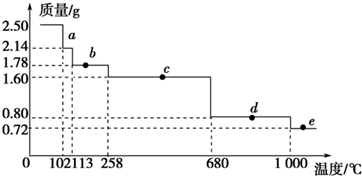
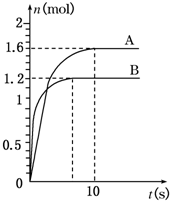
题目内容
14.某温度下,在体积一定的密闭容器中投入反应物达到平衡,已知反应方程式为mX(g)+nY(g)?qZ(g)△H>0,m+n>q,下列叙述正确的是( )| A. | 通惰性气体增大压强,平衡正向移动 | |
| B. | 再加入X,反应吸收的热量增大 | |
| C. | 增加Y的物质的量,X的转化率减小 | |
| D. | 降低温度,c(Y):c(Z)的值变小 |
分析 A、恒容条件下,通入稀有气体使压强增大,反应混合物的浓度不变,正、逆反应速率不变;
B、反应吸收的热量与反应物的物质的量成正比;
C、增加反应物的物质的量,平衡正向移动;
D、降低温度,化学平衡向着放热方向进行.
解答 解:A、恒容条件下,通入稀有气体使压强增大,反应混合物的浓度不变,正、逆反应速率不变,平衡不移动,故A错误;
B、反应吸收的热量与反应物的物质的量成正比,再加入X,反应吸收的热量增大,故B正确;
C、增加Y的物质的量,平衡正向移动,X的转化率增大,故C错误;
D、降低温度,化学平衡向着放热方向进行,即向逆方向进行,$\frac{c(Y)}{c(Z)}$的值变大,故D错误.
故选:B.
点评 本题考查学生影响化学平衡移动的因素:温度、浓度、压强等,注意化学反应的焓变的影响因素,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下.
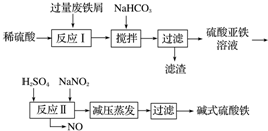
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示.
回答下列问题.
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al(OH)3沉淀,该工艺中“搅拌”的作用是使反应物充分接触反应.
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D(填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al(OH)3沉淀,该工艺中“搅拌”的作用是使反应物充分接触反应.
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D(填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
9.既能与锌发生置换反应,又能与烧碱发生复分解反应的是( )
| A. | CuCl2溶液 | B. | NaCl溶液 | C. | MgSO4溶液 | D. | K2CO3溶液 |
19.下列实验操作正确的是( )
| A. |  滴加液体 | B. |  取用固体 | C. |  测溶液pH | D. |  过滤 |
6.(s已知在25℃时:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3J•mol-,C(石墨)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1 H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=-285.8kJ•mol-则由石墨生成甲烷的反应热△H为:C石墨)+2H2(g)=CH4(g)△H=( )
| A. | -74.8kJ.mol-1 | B. | +74.8kJ.mol-1 | C. | -149.6kJ.mol-1 | D. | +149.6kJ.mol-1 |
 .
.