题目内容
【题目】NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理。已知:NCl3熔点为-40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应。实验室中可用氯气和氨气反应制取NCl3,反应方程式为4NH3+3C12===NCl3+3NH4Cl。某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右)。
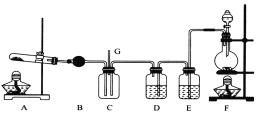
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式:___________________________。
(2)E中的试剂为__________________。
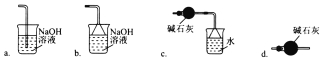
(3)导管G末端应连接的装置为下图中的___________(填选项字母)。
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,写出NCl3水解的化学方程式:_______________。
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为_____________________。
(6)NH4Al(SO4)2也可用于自来水的净化。
①NH4Al(SO4)2溶液中离子浓度由大到小的顺序为_________________。
②向NH4Al(SO4)2溶液中滴加氨水至溶液呈中性,在此过程中水的电离程度_________(填“增大”“减小”或“不变”)。
③常温下,将a mol NH4Al(SO4)2:加入到b L c mol/L的氨水中,所得溶液呈中性,此时溶液中c(Al3+)≈0 mol/L,计算该温度下NH3·H2O的电离常数___________(用含字母的代数式表示,忽略溶液体积变化)。
【答案】(1)MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑ (2)饱和食盐水 (3)c
Mn2++2H2O+Cl2↑ (2)饱和食盐水 (3)c
(4)NCl3+3H2O=NH3↑+3HClO (5)在低于95℃条件下,水浴加热蒸馏(收集70℃馏分)
(6)①c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-) ②减小 ③![]()
【解析】
试题分析:(1)根据装置图可判断,F装置是制取氯气的装置,因此烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑。
Mn2++2H2O+Cl2↑。
(2)浓盐酸易挥发,生成的氯气中含有氯化氢和水蒸气等杂质,应该先用饱和食盐水除去氯化氢杂质,然后再除去水蒸气,因此E中盛有饱和食盐水。
(3)氯气有毒,需要尾气处理。氨气又极易溶于水,需要防止倒吸,根据装置图可知只有c既能吸收可能过量的氯气和氨气,又能防止水进入C装置。
(4)能使湿润的红色石蕊试纸变蓝色的气体为NH3,根据原子守恒可知反应中还有次氯酸生成,反应的化学方程式为NCl3+3H2O=NH3↑+3HClO。
(5)由于NH4Cl能在NCl3中溶解,而NCl3沸点比较低易挥发,因此采用蒸馏的方法。但由于高于95℃时NCl3易爆炸,因此采用水浴加热的方法进行蒸馏,且蒸馏时需要控制温度介于70~95℃之间。
(6)①由于一水合氨的碱性强于氢氧化铝,则铵根的水解程度小于铝离子的水解程度,二者水解均显酸性,因此硫酸铝铵溶液中离子浓度大小关系为c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-)。
②向NH4Al(SO4)2溶液中滴加氨水至溶液呈中性,由于氨水是弱碱,抑制水的电离,则在此过程中水的电离程度减小。
③a mol NH4Al(SO4)2加入到b L c mol/L的氨水中,所得溶液呈中性,铝离子与氨水发生反应,铝离子完全沉淀。根据电荷守恒2c(SO42-)+c(OH-)=c(NH4+)+c(H+)>可知c(NH4+)=2c(SO42-)=![]() 。根据氮原子守恒可知amolNH4Al(SO4)2提供的N原子为amol,bL氨气提供的N原子为bcmol,因此混合溶液中以NH3·H2O形式存在的N原子为(a+bc-4a)mol=(bc-3a)mol,混合溶液中c(NH3·H2O)=
。根据氮原子守恒可知amolNH4Al(SO4)2提供的N原子为amol,bL氨气提供的N原子为bcmol,因此混合溶液中以NH3·H2O形式存在的N原子为(a+bc-4a)mol=(bc-3a)mol,混合溶液中c(NH3·H2O)=![]() ,所以一水合氨的电离常数K=
,所以一水合氨的电离常数K=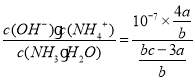 =
=![]() 。
。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题
元素 | 性质或结构信息 |
A | 单质制成的高压灯,发出的黄光透雾力强、射程远。且其单质燃烧后生成淡黄色固体 |
B | 工业上通过分离液态空气获得其单质。原子的最外层电子数是内层电子总数的2.5倍 |
C | 单质是双原子分子,常温、常压下是淡黄绿色气体,原子的L层再增加一个电子即达到稳定结构 |
D | +2价阳离子的核外电子排布与氖原子相同 |
(1)上表中与A属于同一周期的元素是(写元素符号)_____ ,
画出D离子的结构示意图__________________ 。
(2)已知C的单质能与H2O发生置换反应生成O2,写出C单质与水反应的化学方程式_ 。
(3)对元素B的单质或化合物描述正确的是 _。
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下氢气能与单质B反应
(4)A和D两元素活泼性较强的是(写元素名称) _____ 。