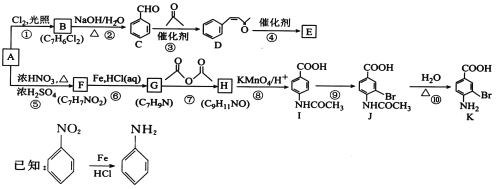
题目内容
【题目】[化学——选修2:化学与技术]
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途。回答下列问题:
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为_________________;该反应在___________________(填设备名称)中进行。
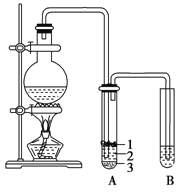
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的______(填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有_______(填设备名称)中用______吸收,得到浓硫酸或发烟硫酸。
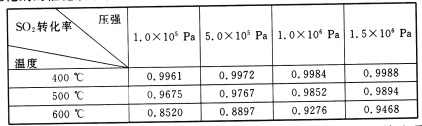
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如下表所示。已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是___________。

(4)欲提高SO2的反应速率和转化率,下列措施可行的是__________(填选项字母)。
A.向装置中通入氮气且保持体积不变 B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂 D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500![]() L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为__________________________________。
L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为__________________________________。
【答案】(1)4FeS2+11O2 ![]() 2Fe2O3+8SO2 沸腾炉 (2)接触室;SO2、SO3、O2;吸收塔;98.3%的H2SO4
2Fe2O3+8SO2 沸腾炉 (2)接触室;SO2、SO3、O2;吸收塔;98.3%的H2SO4
(3)400℃,1个标准大气压 (4)B (5)2NH3H2O+SO2=(NH4)2SO3+H2O
【解析】
试题分析:(1)黄铁矿的主要成分为4FeS2,煅烧时与O2反应生成Fe2O3和SO2,化学方程式为:4FeS2+11O2 ![]() 2Fe2O3+8SO2;黄铁矿煅烧的设备是沸腾炉。
2Fe2O3+8SO2;黄铁矿煅烧的设备是沸腾炉。
(2)SO2转化为SO3在接触室中进行;SO2与O2的反应为可逆反应,所以C处流出的气体有:SO2、SO3、O2;为了防止酸雾的形成,用98.3%的H2SO4吸收SO3,吸收SO3的设备是吸收塔。
(3)因为SO2与O2的反应是放热反应,所以选择的温度为400℃,而1个标准大气压时SO2的转化率已经很大,再增大压强,SO2的转化率提高不大,但会增加生产成本,所以选择1个标准大气压。
(4)A.向装置中通入氮气且保持体积不变,二氧化硫的浓度不变,反应速率不变,转化率也不变,A错误;B.向装置中通入稍过量氧气且保持体积不变,反应速率加快,平衡向正反应方向进行,二氧化硫转化率增大,B正确;C.添加更多的催化剂改变反应速率,但不能改变平衡状态,C错误;D.降低温度,及时转移SO3,平衡向正反应方向进行,但反应速率减小,D错误,答案选B。
(5)SO2为酸性氧化物,与碱反应生成盐和水,化学方程式为:2NH3H2O+SO2=(NH4)2SO3+H2O。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案