题目内容
【题目】【选修2:化学与技术】
地球的海水问题约有1.4×1018t,是人类最大的资源库。
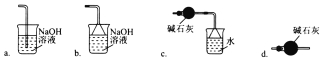
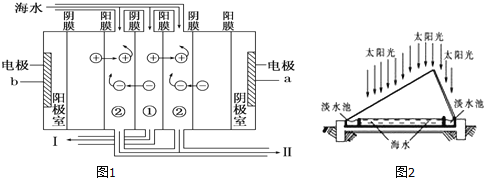
(1)如下图1利用海水得到淡水的方法是___________________________;
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图2所示.a是电源的_________极;Ⅰ口排出的是__________(填“淡水”或“浓水”).
(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和SO42-),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是__________________________;
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大.不少国家正在探索海水提铀的方法.现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素.其反应原理为_______________________ (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为_________________________;
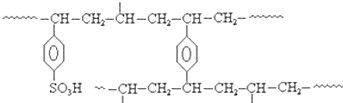
(5)离子交换树脂法是制备纯水(去离子水)的主要方法.某阳离子交换树酯的局部结构可写成(如图).该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经_____________反应得到的.自来水与该离子交换树脂交换作用后显____________(填“酸性”、“碱性”或“中性”).
(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大.如果硬度过大,饮用后对人体健康与日常生活有一定影响.暂时硬水的硬度是由__________(填阴离子符号)引起的,经___________(填操作名称)后可被去掉.永久硬水的硬度可由离子交换法去掉。
【答案】(1)蒸馏法(2)负 淡水(3)除去过量的Na2CO3,并调节溶液的pH值
(4)4HR+U4+=UR4+4H+ UR4+4H+=4HR+U4(5)磺化或取代 酸性(6)HCO3- 加热煮沸
【解析】
试题分析:(1)阳光的照射使池内海水温度升高加快蒸发,形成水蒸气;水蒸气在膜上液化形成小水滴,膜下表面结成的水滴受重力的作用滑到最低处后滴入淡水池,可得到淡水,利用的是蒸馏原理;
(2)分析装置图,阴极室电极和电源负极相连,a为电源负极;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,①室离子浓度变小,②室离子浓度变大,离子浓度大的为浓水,所以浓水在Ⅱ处排出,Ⅰ处排出的是淡水;
(3)浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和SO42-),把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等,先加入过量氯化钡沉淀硫酸根离子,再加入过量氢氧化钠溶液沉淀Mg2+、Fe3+,最后加入过量Na2CO3,沉淀Ca2+、过量的Ba2+,过滤后加入盐酸到不再生成气体为止,除去过量的Na2CO3,并调节溶液的pH值;
(4)螫合型离子交换树脂,它专门吸附海水中的U4+,即4HR+U4+=UR4+4H+,发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,即UR4+4H+=4HR+U4;
(5)依据图3可知由单体苯乙烯和交联剂对二乙烯基苯聚合发生的是加成反应,离子交换树脂法是阳离子交换树酯,依据原理可知交换的是阳离子,金属离子和树脂中氢离子交换,即磺化或取代,溶液呈酸性;
(6)暂时硬水的硬度是由碳酸氢镁,碳酸氢钙引起,阴离子为HCO3-,可以通过加热分解的方法除去,加热分解Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O,Mg(HCO3)2
CaCO3↓+CO2↑+H2O,Mg(HCO3)2![]() MgCO3↓+CO2↑+H2O,MgCO3+H2O
MgCO3↓+CO2↑+H2O,MgCO3+H2O
![]() Mg(OH)2↓+CO2↑,通过反应可知镁离子、钙离子形成沉淀除去。
Mg(OH)2↓+CO2↑,通过反应可知镁离子、钙离子形成沉淀除去。

 优学名师名题系列答案
优学名师名题系列答案【题目】(1).HNO3与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液分别与铜片反应,实验记录如下:
序号 | 浓硝酸与水的体积比 | 实 验 现 象 |
Ⅰ | 1 ﹕1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
Ⅱ | 1 ﹕3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
Ⅲ | 1 ﹕5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
制备NO气体最适宜的是: ,理由是: .
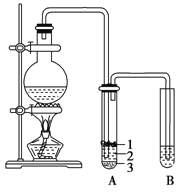
(2).兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠。设计装置如下(忽略装置中空气的影响),请回答下列问题:
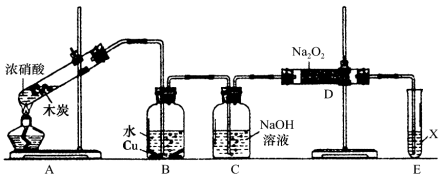
①组装好仪器后,必须进行的一项操作是:_________________。
②推测B中可以观察到的主要现象是:______;C装置的作用是: 。
③装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是:_____。可以通过适当改进,不产生Y物质,请你提出改进方法: _。
④E装置的实验目的是: 。
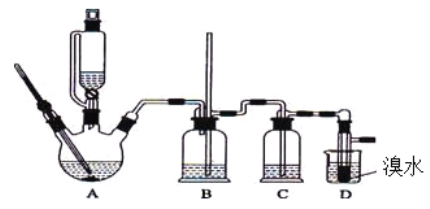
【题目】)实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式 。
(2)装置B的作用是__________________________。
(3)在装置C中应加入 (填字母)。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用 (填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用 的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是
。
(7)判断该制备反应已经结束的最简单方法是 。