题目内容
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
回答下列问题:
(1)SO2(g) + 2CO(g) ![]() S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
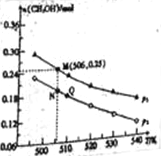
(3)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中CO、NO及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系如图所示。

已知:N2与O2生成NO的反应是吸热反应。请解释:
①随空/燃比增大,CO和CxHy的含量减少的原因是 。
②当空/燃比达到15后,NO减少的原因可能是 。
(4)一定条件下H2与CO合成CH3OH,CH3OH再转化成为CH3OCH3,转化的热化学反应方程式如下:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
在250℃、压强不变的密闭容器中,加入2mol的CH3OH,一段时间后上述反应达平衡,体系放出热量11 kJ;若同一条件下加入0.2mol CH3OCH3和0.2mol H2O,一段时间后上述反应达平衡,体系的热效应为 .
【答案】(1)-267.0KJ/mol;c2(CO2)/c(SO2)·c2(CO);(2)75%;0.045 mol·L-1·min-1 ;
(3)①空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少
②因为反应 N2(g)+O2(g) ![]() 2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NO减少(4)吸收2.7kJ热量
2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NO减少(4)吸收2.7kJ热量
【解析】
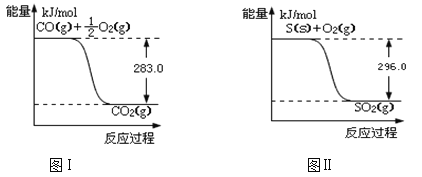
试题分析:(1)由图I可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJmol-1=-566kJmol-1,①
由图II可知,S(s)+O2(g)=SO2(g)△H=-296kJmol-1,②
①-②得:SO2(g)+2CO(g)![]() S(s)+2CO2(g)△H=-563-(-296)=-267kJmol-1,该反应的平衡常数表达式为:c2(CO2)/c(SO2)·c2(CO)。故答案为:-267kJ/mol;c2(CO2)/c(SO2)·c2(CO);
S(s)+2CO2(g)△H=-563-(-296)=-267kJmol-1,该反应的平衡常数表达式为:c2(CO2)/c(SO2)·c2(CO)。故答案为:-267kJ/mol;c2(CO2)/c(SO2)·c2(CO);
(2)设参加反应的CO的浓度为x
CO(g)+H2O(g)CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
K=9.0=![]() ,x=0.225,所以CO的转化率α(CO)=
,x=0.225,所以CO的转化率α(CO)=![]() ×100%=75%,氢气反应速率v(H2)=
×100%=75%,氢气反应速率v(H2)=![]() =0.045mol/(Lmin),故答案为:75%;0.045mol/(Lmin);
=0.045mol/(Lmin),故答案为:75%;0.045mol/(Lmin);
(3)①空/燃比增大,燃油气燃烧更充分,故答案为:空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少;
②反应 N2(g)+O2(g)![]() 2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,故答案为:因为反应 N2(g)+O2(g)
2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,故答案为:因为反应 N2(g)+O2(g)![]() 2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NOx减少;
2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NOx减少;
(4)2mol的CH3OH,一段时间后上述反应达平衡,体系放出热量11 kJ;则1molCH3OCH3(g)和1molH2O(g)反应达到平衡时吸收的热量为24.5-11=13.5 kJ,则0.2mol CH3OCH3和0.2mol H2O达到平衡时吸收的热量为![]() =2.7kJ,故答案为:吸收2.7kJ热量。
=2.7kJ,故答案为:吸收2.7kJ热量。