题目内容
18.一种新型高效净水剂PAFC--聚合氯化铁铝[A1Fe(OH)nC1(6-n)]m,应用非常的广泛.(1)为测定PAFC中Al的含量,采用如图所示流程进行.
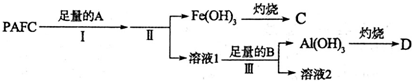
回答下列问题:
①步骤Ⅰ中的试剂A是氢氧化钠溶液(填“氨水”或“氢氧化钠溶液”).
②步骤Ⅲ的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
③实验室进行“灼烧”时所需的陶瓷仪器有坩埚、泥三角.
④溶液2中存在的电荷守恒式为c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),;向溶液2中滴加少量NaOH镕液,则$\frac{c({H}_{2}C{O}_{3})}{c(C{O}_{3}^{2-})}$变小(填“变大”、“变小”或“不变”).
(2)C和某一金属在高温下发生反应可用于焊接钢轨,其化学反应方程为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;某同学在实验室中进行此反应,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,由此该同学确定该固体混合物中无Fe2O3,他的判断是否正确?否(填“是”或“否”);其理由是Fe+2Fe3+=3Fe2+.(用离子方程式解释)
分析 (1)为检测PAFC中Al和Fe含量,PAFC加入足量A为氢氧化钠溶液反应生成氢氧化铁沉淀和偏铝酸钠溶液,氯化钠溶液,过滤后得到氢氧化铁灼烧得到C为氧化铁,滤液Ⅰ中通入过量的B为二氧化碳气体和偏铝酸钠溶液反应生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,灼烧得到D为氧化铝;
①步骤Ⅰ中的试剂A为氢氧化钠溶液;
②步骤Ⅲ的反应为偏铝酸钠溶液中通入过量二氧化碳气体生成氢氧化铝沉淀;
③依据固体灼烧所需陶瓷仪器为坩埚,泥三角分析;
④溶液2为碳酸氢钠溶液和氯化钠溶液的混合物,溶液中阴阳离子所带电荷数相同,向溶液2中滴加少量NaOH镕液和碳酸氢钠反应生成碳酸钠和水,碳酸根离子浓度增大,碳酸浓度减小;
(2)铝热反应需要引发剂引发高温反应,用少量氯酸钾和镁条引发,点燃镁条燃烧放热使氯酸钾分解生成氧气助燃产生反应引发所需要的温度,铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无铁离子,但不能说明固体中不含氧化铁,因为铝热反应生成铁,溶解于硫酸中铁可以还原铁离子为亚铁离子分析书写离子方程式.
解答 解:(1)为检测PAFC中Al和Fe含量,PAFC加入足量A为氢氧化钠溶液反应生成氢氧化铁沉淀和偏铝酸钠溶液,氯化钠溶液;过滤后得到氢氧化铁灼烧得到C为氧化铁,滤液Ⅰ中通入过量的B为二氧化碳气体和偏铝酸钠溶液反应生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,灼烧得到D为氧化铝;
①步骤Ⅰ中的试剂A为氢氧化钠溶液,故答案为:氢氧化钠溶液;
②步骤Ⅲ的反应为偏铝酸钠溶液中通入过量二氧化碳气体生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
③实验室进行“灼烧”是灼烧氢氧化铝固体,固体灼烧所需陶瓷仪器为坩埚、泥三角;
故答案为:坩埚、泥三角;
④溶液2为碳酸氢钠溶液和氯化钠溶液,溶液中阴阳离子所带电荷数相同,溶液中存在电荷守恒为:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),向溶液2中滴加少量NaOH镕液和碳酸氢钠反应生成碳酸钠和水,NaHCO3+NaOH=Na2CO3+H2O,碳酸根离子浓度增大,碳酸浓度减小,$\frac{c({H}_{2}C{O}_{3})}{c(C{{O}_{3}}^{2-})}$比值减小;
故答案为:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-);变小;
(2)由于Al、Fe以及Fe2O3的物质的量关系无法确定,则不能确定溶液中Fe元素的存在形成是否有Fe3+,所得酸性溶液中,不能确定是否一定存在的阳离子为Fe3+;铝热反应需要引发剂引发高温反应,用少量氯酸钾和镁条引发,点燃镁条燃烧放热使氯酸钾分解生成氧气助燃产生反应引发所需要的温度发生反应,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无铁离子,但不能说明固体中不含氧化铁,因为铝热反应生成铁溶解于硫酸中铁可以还原铁离子为亚铁离子,离子方程式为:Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,不能确定该固体混合物中无Fe2O3;
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;否;Fe+2Fe3+=3Fe2+.
点评 本题考查了铝及其化合物性质的分析应用,主要是过程分析判断,电解质溶液中离子性质和电荷守恒,实验基本操作的应用,掌握基础是关键,题目难度中等.

| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )| A. | Q>0 | B. | 600K时,Y点甲醇的υ(正)<υ(逆) | ||
| C. | 从Y点到Z点可通过增大压强实现 | D. | 从Y点到X点可通过使用催化剂实现 |
| 稀盐酸的质量 | 剩余固体的质量 |
| 第1次加入5g | 1.315g |
| 第2次加入5g | 0.63g |
| 第3次加入5g | 0.3g |
| 第4次加入5g | 0.3g |
(2)石灰石样品的纯度为;
(3)100Kg这种纯度的石灰石充分煅烧后,可得到固体多少克?
| A. | 为防止药品滴在桌面上,胶头滴管可伸入试管内部滴加液体 | |
| B. | 用量筒取13.37mL的稀硫酸 | |
| C. | 给试管内液体加热时,液体体积不超过试管容积的1/4 | |
| D. | 向酒精灯内添加酒精时,不能超过酒精灯容积的2/3 |
| A. | 向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH-=H2O | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 表示硫酸与氢氧化钡反应的中和热的热化学反应方程式为:$\frac{1}{2}$ H2SO4(aq)+$\frac{1}{2}$ Ba(OH)2(aq)=$\frac{1}{2}$ BaSO4(s)+H2O(l)△H=-57.3 kJ/mol | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
 今年四、五月份,我国湖北、江西等地遭遇大范围持续干旱----鄱阳湖干涸等.全国人们团结一致,共同抗旱.
今年四、五月份,我国湖北、江西等地遭遇大范围持续干旱----鄱阳湖干涸等.全国人们团结一致,共同抗旱. 无水芒硝(Na2SO4)与硫化钠(Na2S)是用化工和能源重化工的基础原料,工业上常用天然气、焦炭及氢气等还原法由芒硝制取硫化钠.
无水芒硝(Na2SO4)与硫化钠(Na2S)是用化工和能源重化工的基础原料,工业上常用天然气、焦炭及氢气等还原法由芒硝制取硫化钠.