题目内容
4.由乙烯和无机试剂制备二乙酸乙二酯,不可能涉及的反应类型是( )| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 氧化反应 |
分析 乙烯和氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷水解生成乙二醇,乙烯与水加成生成乙醇,乙醇在Cu、加热条件下发生催化氧化生成乙醛,乙醛进一步氧化为乙酸,乙醇与二乙酸发生酯化反应成二乙酸乙二酯,据此判断即可.
解答 解:乙烯和氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷水解生成乙二醇,乙烯与水加成生成乙醇,乙醇在Cu、加热条件下发生催化氧化生成乙醛,乙醛进一步氧化为乙酸,乙醇与二乙酸发生酯化反应成二乙酸乙二酯,故涉及的反应类型有:加成反应、取代反应、氧化反应,没有消去反应,故选B.
点评 本题考查有机物的合成,题目难度中等,掌握官能团的性质与转化是关键,旨在考查学生对基础知识的掌握,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
15.下列有关实验装置进行的相应实验,能达到实验目的是 ( )
| A. | 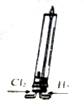 该装置可模拟工业制取氯化氢 | |
| B. | 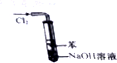 如图实验装置可以处理Cl2尾气,并防止倒吸 | |
| C. |  如图实验制取少量的Fe(OH)3胶体 | |
| D. | 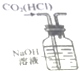 如图实验装置可除去CO2气体中含有的少量HCl杂质 |
12.根据官能团的分类,分子式为C7H8O的芳香族化合物共有( )种.
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
19.在反应A+2HCl═MgCl2+2B中A可能是下列物质中的( )
| A. | Mg | B. | MgO | C. | Mg(OH)2 | D. | MgCO3 |
5.某实验小组的同学为了探究CuSO4溶液与Na2CO3溶液的反应原理并验证产物,进行如下实验.
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体.该小组同学猜想此固体为xCuCO3•yCu(OH)2.
(1)为了验证猜想,先进行定性实验.
(2)为进一步确定蓝绿色固体的组成,使用如下装置再进行定量实验.

实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中.
①装置C中盛放的试剂是无水氯化钙,装置E的作用是防止空气中的二氧化碳和水蒸气进入装置D影响测定结果,反应结束时要通入适量的空气,其作用是使分解产生的水蒸气、二氧化碳气体全部进入装置C、D中吸收.
②实验结束后,测得装置C增重0.270g,装置D增重1.320g.则该蓝绿色固体的化学式为2CuCO3•Cu(OH)2.
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式2CuSO4+2Na2CO3+H2O=CuCO3•Cu(OH)2↓+CO2↑+Na2SO4.
(4)已知20℃时溶解度数据:S[Ca(OH)2]=0.16g,S[Ba(OH)2]=3.89g.有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是Ba(OH)2溶解度大于Ca(OH)2,相同体积的饱和氢氧化钡溶液吸收二氧化碳多.
(5)有同学为了降低实验误差,提出如下建议,其中合理的是(填字母序号).
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置.
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体.该小组同学猜想此固体为xCuCO3•yCu(OH)2.
(1)为了验证猜想,先进行定性实验.
| 实验序号 | 实验步骤 | 实验现象 | 结论 |
| 实验Ⅱ | 取适量蓝绿色固体,加入足量稀硫酸 | 固体溶解,生成蓝色溶液, 产生无色气体 | 蓝绿色固体中含有C${{O}_{3}}^{2-}$ |

实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中.
①装置C中盛放的试剂是无水氯化钙,装置E的作用是防止空气中的二氧化碳和水蒸气进入装置D影响测定结果,反应结束时要通入适量的空气,其作用是使分解产生的水蒸气、二氧化碳气体全部进入装置C、D中吸收.
②实验结束后,测得装置C增重0.270g,装置D增重1.320g.则该蓝绿色固体的化学式为2CuCO3•Cu(OH)2.
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式2CuSO4+2Na2CO3+H2O=CuCO3•Cu(OH)2↓+CO2↑+Na2SO4.
(4)已知20℃时溶解度数据:S[Ca(OH)2]=0.16g,S[Ba(OH)2]=3.89g.有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是Ba(OH)2溶解度大于Ca(OH)2,相同体积的饱和氢氧化钡溶液吸收二氧化碳多.
(5)有同学为了降低实验误差,提出如下建议,其中合理的是(填字母序号).
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置.
12.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号或化学式,下同).原子结构示意图为 .
.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的是:KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)元素的气态氢化物中成碱性的物质是NH3,该元素氢化物与其最高价氧化物对应水化物反应的化学方程式为NH3+HNO3=NH4NO3.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的是:KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)元素的气态氢化物中成碱性的物质是NH3,该元素氢化物与其最高价氧化物对应水化物反应的化学方程式为NH3+HNO3=NH4NO3.
9. 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )| A. | Q>0 | B. | 600K时,Y点甲醇的υ(正)<υ(逆) | ||
| C. | 从Y点到Z点可通过增大压强实现 | D. | 从Y点到X点可通过使用催化剂实现 |
10.下列实验操作正确的是( )
| A. | 为防止药品滴在桌面上,胶头滴管可伸入试管内部滴加液体 | |
| B. | 用量筒取13.37mL的稀硫酸 | |
| C. | 给试管内液体加热时,液体体积不超过试管容积的1/4 | |
| D. | 向酒精灯内添加酒精时,不能超过酒精灯容积的2/3 |