题目内容
17.天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.(1)已知:①CH4(g)+2O2 =CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1
②CO(g)+H2O(g)=H2(g)+CO2(g)△H+2.8 kJ•mol-1
③2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ•mol-1
则反应CH4(g)+CO2(g)?2CO+2H2(g)△H=+247.3kJ•mol-1
(2)天然气的一个重要用途是制取H2,其原理为:CH4(g)+CO2(g)?2CO(g)+2H2(g).一定条件下,在密闭容器中,通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在发生反应,测得CH4的平衡转化率与温度及压强的关系如图l所示,
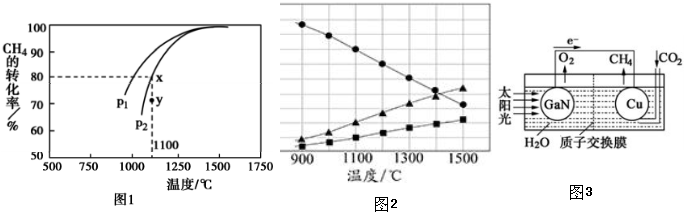
①该反应的平衡常数表达式为$\frac{{c}^{2}(CO)•{c}^{2}({H}_{2})}{c(C{O}_{2})•c(C{H}_{4})}$
②则压强P1小于P2 (填“大于”或“小于”);压强为P2时,在Y点:v(正)大于v(逆)(填“大于“、“小于”或“等于“).
(3)天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式2NH4HS+O2=2NH3•H2O+2S↓.
(4)工业上又常将从天然气分离出的H2S,在高温下分解生成硫蒸气和H2,若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图2所示,H2S在高温下分解反应的化学方程式为2H2S?2H2+S2
(5)科学家用氮化镓材料与铜组装如图3的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.
①写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.
②为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(选填“盐酸”或“硫酸”).
分析 (1)根据盖斯定律分析解答;
(2)①根据化学平衡常数表达的意义书写,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
②该反应正向为体积增大的方向,压强越大,CH4的转化率越小;压强为P2时,在Y点反应未达到平衡,则反应正向移动;
(3)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质;
(4)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,再结合反应条件书写方程式;(5)①由电池装置图可知,Cu上二氧化碳得电子生成甲烷;
②根据酸的挥发性分析;
解答 解:(1)根据盖斯定律,:①CH4(g)+2O2 =CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1
②CO(g)+H2O(g)=H2(g)+CO2(g)△H+2.8 kJ•mol-1
③2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ•mol-1
则反应CH4(g)+CO2(g)?2CO+2H2(g)△H=①-2③+2②=-890.3-2×(-566)+2×2.8=+247.3kJ•mol-1,故答案为:+247.3kJ•mol-1;
(2)①已知CH4(g)+CO2(g)?2CO(g)+2H2(g),其平衡常数表达式是K=$\frac{{c}^{2}(CO)•{c}^{2}({H}_{2})}{c(C{O}_{2})•c(C{H}_{4})}$,故答案为:K=$\frac{{c}^{2}(CO)•{c}^{2}({H}_{2})}{c(C{O}_{2})•c(C{H}_{4})}$;
②该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
故答案为:小于;大于;
(3)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质,则一定条件下向NH4HS溶液中通入空气,得到单质硫和氨水,则反应方程式为:2NH4HS+O2=2NH3•H2O+2S↓;
故答案为:2NH4HS+O2=2NH3•H2O+2S↓;
(4)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,所以该反应方程式为2H2S?2H2+S2,故答案为:2H2S?2H2+S2;
(5)①由电池装置图可知,Cu上二氧化碳得电子生成甲烷,则Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O;
故答案为:CO2+8e-+8H+=CH4+2H2O;
②可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸;
故答案为:硫酸.
点评 本题考查了原电池原理、方程式的书写、化学平衡常数、平衡移动等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.

| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 在试管中滴入适量C2H5X与NaOH溶液,振荡、加热、静置分层后,取水层加稀硝酸酸化,再滴加数滴AgNO3溶液 | 淡黄色沉淀 | 证明卤代烃中含有溴元素 |
| B | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| C | 在大试管中依次加入适量丁醇、过量乙酸、几滴浓硫酸,混合后塞上带长导管的试管塞,放在石棉网上方空气中加热至120℃左右 | 反应液沸腾,冷却静置,上层油状透明液体有水果香味 | 该油状液体为乙酸丁酯 |
| D | 在简易启普发生器中向石灰石中加入浓醋酸,将产生的气体直接通入苯酚钠溶液中 | 苯酚钠溶液产生浑浊 | 酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体.该小组同学猜想此固体为xCuCO3•yCu(OH)2.
(1)为了验证猜想,先进行定性实验.
| 实验序号 | 实验步骤 | 实验现象 | 结论 |
| 实验Ⅱ | 取适量蓝绿色固体,加入足量稀硫酸 | 固体溶解,生成蓝色溶液, 产生无色气体 | 蓝绿色固体中含有C${{O}_{3}}^{2-}$ |

实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中.
①装置C中盛放的试剂是无水氯化钙,装置E的作用是防止空气中的二氧化碳和水蒸气进入装置D影响测定结果,反应结束时要通入适量的空气,其作用是使分解产生的水蒸气、二氧化碳气体全部进入装置C、D中吸收.
②实验结束后,测得装置C增重0.270g,装置D增重1.320g.则该蓝绿色固体的化学式为2CuCO3•Cu(OH)2.
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式2CuSO4+2Na2CO3+H2O=CuCO3•Cu(OH)2↓+CO2↑+Na2SO4.
(4)已知20℃时溶解度数据:S[Ca(OH)2]=0.16g,S[Ba(OH)2]=3.89g.有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是Ba(OH)2溶解度大于Ca(OH)2,相同体积的饱和氢氧化钡溶液吸收二氧化碳多.
(5)有同学为了降低实验误差,提出如下建议,其中合理的是(填字母序号).
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的是:KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)元素的气态氢化物中成碱性的物质是NH3,该元素氢化物与其最高价氧化物对应水化物反应的化学方程式为NH3+HNO3=NH4NO3.
| A. | Na、Mg、Al原子的失电子能力依次增强 | |
| B. | Li、Na、K的最高价氧化物对应的水化物的碱性依次减弱 | |
| C. | Si、P、S元素的气态氢化物的稳定性依次降低 | |
| D. | C、N、O的原子半径依次减小 |
 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )| A. | Q>0 | B. | 600K时,Y点甲醇的υ(正)<υ(逆) | ||
| C. | 从Y点到Z点可通过增大压强实现 | D. | 从Y点到X点可通过使用催化剂实现 |
| A. | 向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH-=H2O | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 表示硫酸与氢氧化钡反应的中和热的热化学反应方程式为:$\frac{1}{2}$ H2SO4(aq)+$\frac{1}{2}$ Ba(OH)2(aq)=$\frac{1}{2}$ BaSO4(s)+H2O(l)△H=-57.3 kJ/mol | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
 今年四、五月份,我国湖北、江西等地遭遇大范围持续干旱----鄱阳湖干涸等.全国人们团结一致,共同抗旱.
今年四、五月份,我国湖北、江西等地遭遇大范围持续干旱----鄱阳湖干涸等.全国人们团结一致,共同抗旱.