题目内容
7.下列实验做法不正确的是( )| A. | 用无水硫酸铜检验乙醇中是否含水 | |
| B. | 用溴水检验汽油中是否含有不饱和脂肪烃 | |
| C. | 用蒸馏的方法可以分离醋酸与乙醇的混合物 | |
| D. | 检验某卤代烃中是否含溴:加入NaOH溶液,加热,冷却,再加入硝酸银溶液 |
分析 A.无水硫酸铜遇水变蓝;
B.汽油中也可能有不饱和键的,也能与溴水发生加成反应;
C.醋酸和乙醇的沸点不同;
D.没有酸化直接加入硝酸银,则生成的沉淀可能为氢氧化银.
解答 解:A.无水硫酸铜遇水变蓝,则用无水硫酸铜检验乙醇中是否含水,故A正确;
B.汽油中也可能有不饱和键的,所以溴水不能检验汽油中是否含有不饱和脂肪烃,故B错误;
C.醋酸和乙醇的沸点不同,可以用蒸馏的方法分离,故C正确;
D.加入NaOH溶液,加热”为卤代烃发生水解取代反应,有溴离子,但若没有酸化直接加入硝酸银,则生成的沉淀可能为氢氧化银等,故D错误.
故选BD.
点评 本题考查物质的分离、提纯、鉴别等实验方案的设计,题目难度中等,注意把握相关物质的性质,为解答此类题目的关键.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
10.某学生为了完成一个家庭小实验,自制烷烃的分子模型,对于CnH2n+2的烷烃,做球棍模型时,除需做3n+2个球外还需要的棍(共价键)数为( )
| A. | 3n+2 | B. | 3n+1 | C. | 3n | D. | 3n-1 |
18.下列溶液一定呈中性的是( )
| A. | pH=7的溶液 | |
| B. | c(H+)=c(OH-)的溶液 | |
| C. | 由强酸、强碱等物质的量反应得到的溶液 | |
| D. | 盐溶于水得到的溶液 |
15.合理开发和利用海水资源是世界各国研究的课题.下列对于海水利用的认识错误的是( )
| A. | 海水中蕴藏有丰富的资源,人类可以大量开发,以弥补资源的短缺 | |
| B. | 海水可以成为廉价的资源基地,但要合理开发,综合利用 | |
| C. | 可以用太阳能电解海水以获取氢能源 | |
| D. | 人类在利用海水时要兼顾海洋生物和海洋生态平衡 |
2.填写下表:
| 分子或离子 | SO3 | SO2 | ClO3- | HCN | NF3 | NO3- |
| 中心原子孤电子对数 | 0 | 1 | 1 | 0 | 1 | 0 |
| σ键电子对数 | 3 | 2 | 3 | 2 | 3 | 3 |
| 中心原子的杂化轨道类型 | Sp2 | Sp2 | Sp3 | Sp | Sp3 | Sp2 |
| VSEPR模型名称 | 平面三角形 | V形 | 四面体 | 直线形 | 四面体 | 平面三角形 |
| 分子或离子立体构型名称 | 平面三角形 | V形 | 三角锥 | 直线形 | 三角锥 | 平面三角形 |
12.据最新报道,放射性同位素钬${\;}_{67}^{166}$Ho可有效地治疗肝癌.该同位素原子内中子数为( )
| A. | 99 | B. | 67 | C. | 32 | D. | 166 |
19.用惰性电极电解下列足量的溶液,一段时间后,再加入一定量的另一物质(括号内)后,溶液能与原来溶液浓度一样的是( )
| A. | CuCl2(CuCl2溶液) | B. | AgNO3(Ag2O) | C. | NaCl(HCl溶液) | D. | CuSO4(Cu(OH)2) |
16.下列推断正确的是( )
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2CO3、NaHCO3都是盐,都能与CaCl2溶液反应 | |
| C. | CO、NO都是大气污染气体,在空气中都能稳定存在 | |
| D. | Fe和Al都是金属,都不能与碱溶液反应 |
17.海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间,某地海水中主要离子的含量如下表:
(1)海水显弱碱性的原因是(用离子方程式表示)HCO3-+H2O?H2CO3+OH-.该海水中Ca2+的物质的量浓度为5×10-3 mol•L-1.
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
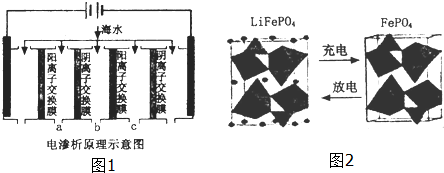
①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.

①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.