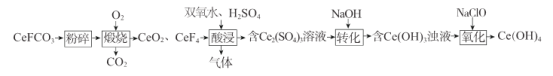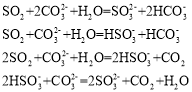题目内容
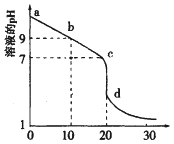
【题目】常温下,向1L0.1 molL—l 一元酸HR溶液中逐渐通入氨气[已知常温下NH3 H2O电离平衡常数K = l .76x 10-5], 使溶液温度和体积保持不变, 混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
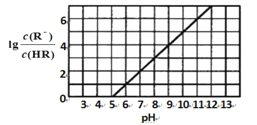
A.0. l molL—1HR 溶液的pH为5
B.HR为弱酸,常温时随着氨气的通入,c(R—)/[c(OH—).c(HR)] 逐渐增大
C.当通入0.1 mol NH3时,c(NH4+ > c(R—)
D.当c(R— )=c(HR)时 溶液必为中性
【答案】C
【解析】
A.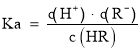 ,当
,当 时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L;
时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L;
B.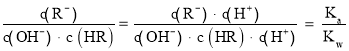 ,电离平衡常数、离子积常数都只与温度有关;
,电离平衡常数、离子积常数都只与温度有关;
C.当通入0.1molNH3时,反应恰好生成NH4R,NH4+的水解平衡常数为![]() ,HR水解平衡常数
,HR水解平衡常数![]() ,根据电荷守恒即NH4+和R的水解程度大小分析;
,根据电荷守恒即NH4+和R的水解程度大小分析;
D.当c(HR)=c(R)时,溶液的pH=5。
A.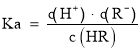 ,当
,当 时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L,则溶液中
时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L,则溶液中![]() ,溶液的pH=3,故A错误;
,溶液的pH=3,故A错误;
B. 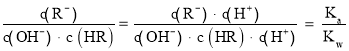 ,电离平衡常数、离子积常数都只与温度有关,温度不变,电离平衡常数及离子积常数不变,则
,电离平衡常数、离子积常数都只与温度有关,温度不变,电离平衡常数及离子积常数不变,则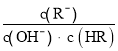 不变,故B错误;
不变,故B错误;
C.当通入0.1molNH3时,反应恰好生成NH4R,NH4+的水解平衡常数为![]() ,HR水解平衡常数
,HR水解平衡常数![]() ,所以NH4+的水解程度小于R的水解程度,溶液呈碱性,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH)+c(R),由于c(OH)>c(H+),所以c(NH4+)>c(R),则溶液中离子浓度大小为c(NH4+)>c(R)>c(OH)>c(H+),故C正确;
,所以NH4+的水解程度小于R的水解程度,溶液呈碱性,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH)+c(R),由于c(OH)>c(H+),所以c(NH4+)>c(R),则溶液中离子浓度大小为c(NH4+)>c(R)>c(OH)>c(H+),故C正确;
D.当c(HR)=c(R)时, ,溶液的pH=5,溶液呈酸性,故D错误;
,溶液的pH=5,溶液呈酸性,故D错误;
故答案选:C。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式___。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤___。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
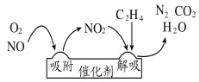
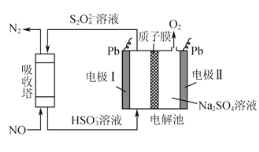
(2)间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。电极Ⅰ为___极,电极反应式为___,吸收塔中的反应为____,每处理1molNO,可同时得到___gO2。
(3)“重油-氧气-熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是(______)
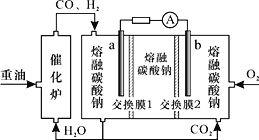
A.O2在b极得电子,最终被还原为CO32-
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32-经“交换膜2”移向b极
D.H2参与的电极反应为H2-2e-+CO32-=H2O+CO2