题目内容
【题目】已知:W、X、Y、Z、T 均为短周期元素,且原子半径依次增大。请填空:
(1)W、Z是形成化合物种类最多的两种元素,写出Z的核外电子的轨道表示式______________。
(2)化合物YW3溶于水能使酚酞变红,用方程式表示酚酞变红的原因____。
(3)元素T的原子中电子占据7根轨道,则T在元素周期表____周期___族;T的化合物TY熔融时不导电,常用作砂轮与耐高温材料,由此推知,它属于____。
a离子晶体b原子晶体c分子晶体d无法判断
(4)YX3与YW3具有相同的分子空间构型,YX3属于______(填“极性”、“非极性”)分子,其中Y的化合价为____。
【答案】![]() NH3+H2O NH3H2O NH4++OH- 三 IIIA b 极性 +3
NH3+H2O NH3H2O NH4++OH- 三 IIIA b 极性 +3
【解析】
(1)W、Z是形成化合物种类最多的两种元素,化合物种类最多的是烃,则W是H元素、Z是C元素;原子核外有6个电子,分别位于1s、2s、2p轨道,其原子核外电子轨道表示式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)化合物YW3的水溶液能使酚酞变红,说明该物质为NH3,氨气和水反应生成一水合氨,一水合氨电离生成氢氧根离子而导致溶液呈碱性,碱遇酚酞试液变红色,故答案为:NH3+H2O NH3H2O NH4++OH-;
(3)元素T的原子中电子共占据了7个轨道,则T为Al元素,Al原子核外有3个电子层、最外层电子数是3,所以位于第三周期第IIA族;Al的化合物AIN熔融时不导电,常用作砂轮及耐高温材料,说明该物质属于原子晶体,故选b;故答案为:三;IIIA;b;
(4)NX3与NH3具有相同的分子空间构型,X为第VIIA族元素,其原子半径小于N元素,则X为F元素,氨气分子为三角锥形结构,则NF3也是三角锥形结构,该分子正负电荷重心不重合,为极性分子;NF3中N元素电负性小于F元素,所以N元素显+3价、F元素显-1价,故答案为:极性;+3。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
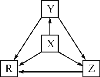
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D