题目内容
18.下列反应对应的离子方程式正确的是( )| A. | 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| B. | 过氧化钠溶于水:2022-+2H2O=4OH-+O2↑ | |
| C. | 用MnO2从酸化的海带灰中浸取液中提取碘:MnO2+2I-+2H2O=Mn2++I2+4OH- | |
| D. | 向偏铝酸钠溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
分析 A.反应生成碳酸钙、NaOH和水;
B.过氧化钠在离子反应中保留化学式;
C.酸性溶液中不能生成大量的氢氧根离子;
D.反应生成氢氧化铝和碳酸氢钠.
解答 解:A.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合的离子反应为HCO3-+Ca2++OH-=CaCO3↓+H2O,故A正确;
B.过氧化钠溶于水的离子反应为2Na202+2H2O=4OH-+4Na++O2↑,故B错误;
C.用MnO2从酸化的海带灰中浸取液中提取碘的离子反应为MnO2+2I-+4H+=Mn2++I2+2H2O,故C错误;
D.向偏铝酸钠溶液中通入过量的CO2的离子反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故D错误;
故选A.
点评 本题考查了离子方程式的正误判断,为高频考点,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等,题目难度不大.

练习册系列答案
相关题目
8.利用右图所示装置进行下列实验,不能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 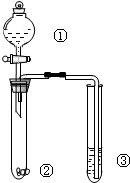 |
| A | 浓盐酸 | KMnO4 | NaBr溶液 | 氧化性:KMnO4>Cl2>Br2 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
| D | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硫酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
9.碘是一种易溶于酒精,苯,汽油,四氯化碳的物质,现有碘的水溶液,要从碘水中萃取出碘,下列试剂不能用作萃取剂的是( )
| A. | 四氯化碳 | B. | 汽油 | C. | 酒精 | D. | 苯 |
6.完全燃烧一定量的无水乙醇(C2H5OH),放出的热量为Q,用6mol/L的NaOH溶液吸收燃烧放出的CO2,消耗50mL时,生成等物质的量的Na2CO3和NaHCO3.则燃烧1mol无水乙醇时放出的热量为( )
| A. | 0.2Q | B. | 0.1Q | C. | 5Q | D. | 10Q |
13.下列与化学概念有关的说法正确的是( )
| A. | SiO2、P2O5、NO均为酸性氧化物 | |
| B. | NaH、NaBH4、NaClO均为离子化合物 | |
| C. | NH3.H2O是弱碱,所以NH4NO3为弱电解质 | |
| D. | 磁性氧化铁、水玻璃、液氨均为混合物 |
3.已知如图转化关系中,甲、乙均为单质,下列判断正确的是( )


| A. | 甲可能是钠 | B. | 乙可能是氢气 | ||
| C. | 丙可能是氧化铝 | D. | 丙可能是三氧化硫 |
10.下列关于仪器使用和操作的说法中不正确的是( )
| A. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| B. | 蒸馏时温度计水银球可以高于蒸馏烧瓶支管口 | |
| C. | 振摇分液漏斗时应关闭其玻璃塞和活塞 | |
| D. | 除去KNO3中少量NaCl:将混合物制成热的饱和溶液,冷却结晶,过滤 |
7.在标准状况下,a mol气体A分子与b mol气体B分子的质量相同.则与此有关的下列说法中正确的是( )
| A. | A与B的摩尔质量之比为a:b | |
| B. | 相同状况下,同体积的A与B的质量之比为a:b | |
| C. | 质量相同的A与B的体积之比为b:a | |
| D. | 同温同压下,A与B的密度之比为b:a |
8.有一水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:(注:已知NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O)
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.04mol气体;
第三份加足量BaCl2溶液后,得到干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g
综合上述实验,你认为以下结论正确的是( )
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.04mol气体;
第三份加足量BaCl2溶液后,得到干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g
综合上述实验,你认为以下结论正确的是( )
| A. | 加入AgNO3溶液后生成的沉淀一定是AgCl | |
| B. | 该混合液中-定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+ | |
| D. | 该混合液中:c(K+)≥0.2mol/L c(CO32-)=0.2mol/L |