题目内容
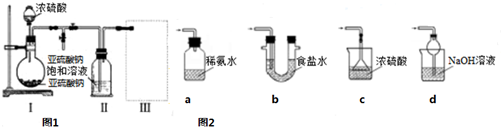
8.利用右图所示装置进行下列实验,不能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | KMnO4 | NaBr溶液 | 氧化性:KMnO4>Cl2>Br2 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
| D | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硫酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,浓盐酸和高锰酸钾反应生成氯气,高锰酸钾是氧化剂、氯气是氧化产物,氯气能氧化溴离子生成溴,氧化剂是氯气、溴是氧化产物;
B.浓硫酸使蔗糖变黑,然后C与浓硫酸发生氧化还原反应生成二氧化硫,二氧化硫与溴水发生氧化还原反应使其褪色;
C.稀盐酸和亚硫酸钠反应生成二氧化硫,二氧化硫和硝酸钡发生氧化还原反应生成硫酸钡;
D.稀硫酸和碳酸钠反应生成二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸,强酸制取弱酸.
解答 解:A.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,浓盐酸和高锰酸钾反应生成氯气,高锰酸钾是氧化剂、氯气是氧化产物,氯气能氧化溴离子生成溴,氧化剂是氯气、溴是氧化产物,所以氧化性:KMnO4>Cl2>Br2,故A正确;
B.浓硫酸使蔗糖变黑,然后C与浓硫酸发生氧化还原反应生成二氧化硫,二氧化硫与溴水发生氧化还原反应使其褪色,则浓硫酸体现脱水性和氧化性,故B正确;
C.稀盐酸和亚硫酸钠反应生成二氧化硫,二氧化硫和硝酸钡发生氧化还原反应生成硫酸钡,二氧化硫和硝酸钡反应生成白色沉淀体现二氧化硫还原性,故C错误;
D.稀硫酸和碳酸钠反应生成二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸,强酸制取弱酸,所以酸性:硫酸>碳酸>硅酸,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及强酸制取弱酸、氧化还原反应、浓硫酸性质、氧化性强弱判断等知识点,明确实验原理及物质性质是解本题关键,易错选项是C.

练习册系列答案
相关题目
18.下列说法不正确的是( )
| A. | 利用风能发电、采取节能技术、使用太阳能热水器均有利于减少二氧化碳排放 | |
| B. | 生活垃圾焚烧发电也会产生有毒有害物质 | |
| C. | 丁达尔现象可用于区别溶液与胶体,云、雾、淀粉溶液均能产生丁达尔现象 | |
| D. | 硅酸钠溶液的保存和碱溶液一样,存放在橡胶塞密封的广口试剂瓶中 |
19.下列关于热化学反应的描述中正确的是( )
| A. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ•mol-1 | |
| B. | H2SO4和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ•mol-1 | |
| C. | 有气体参加的化学反应,增大压强,可增大活化分子百分数,从而使反应速率增大 | |
| D. | 在101Kpa时,物质完全燃烧生成稳定氧化物时所放出的热量,叫做该物质的燃烧热 |
16.在反应2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O中,
①被还原的物质是KMnO4,还原剂是HCl(填化学式).
②若反应生成0.5mol Cl2,则转移NA个电子.
①被还原的物质是KMnO4,还原剂是HCl(填化学式).
②若反应生成0.5mol Cl2,则转移NA个电子.
17.已知X+、Y2+、Z-、W2-四种离子具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,不正确的是( )
| A. | 金属性:X>Y,还原性:Z->W2- | B. | 原子半径:X>Y>W>Z | ||
| C. | 离子半径:Y2+<X+<Z-<W2- | D. | 原子序数:Y>X>Z>W |
18.下列反应对应的离子方程式正确的是( )
| A. | 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| B. | 过氧化钠溶于水:2022-+2H2O=4OH-+O2↑ | |
| C. | 用MnO2从酸化的海带灰中浸取液中提取碘:MnO2+2I-+2H2O=Mn2++I2+4OH- | |
| D. | 向偏铝酸钠溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
 某溶液含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案):
某溶液含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案):