题目内容
6.完全燃烧一定量的无水乙醇(C2H5OH),放出的热量为Q,用6mol/L的NaOH溶液吸收燃烧放出的CO2,消耗50mL时,生成等物质的量的Na2CO3和NaHCO3.则燃烧1mol无水乙醇时放出的热量为( )| A. | 0.2Q | B. | 0.1Q | C. | 5Q | D. | 10Q |
分析 根据CO2与NaOH溶液反应,根据钠守恒以及生成等物质的量的Na2CO3和NaHCO3计算出CO2的物质的量,进而计算出乙醇的物质的量,根据乙醇的物质的量和热量的关系求出.
解答 解:n(NaOH)=0.05L×6mol/L=0.3mol,根据钠守恒,n(Na2CO3)=0.1mol,n(NaHCO3)=0.1mol,所以n(CO2)=0.2mol,则n(C2H6O)=$\frac{1}{2}$×n(CO2)=0.1mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为10Q,
故选D.
点评 本题考查烃燃烧的有关计算,难度中等,可以根据方程式计算,本题采取守恒计算,简化计算,注意守恒思想在计算中的运用.

练习册系列答案
相关题目
16.在反应2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O中,
①被还原的物质是KMnO4,还原剂是HCl(填化学式).
②若反应生成0.5mol Cl2,则转移NA个电子.
①被还原的物质是KMnO4,还原剂是HCl(填化学式).
②若反应生成0.5mol Cl2,则转移NA个电子.
17.已知X+、Y2+、Z-、W2-四种离子具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,不正确的是( )
| A. | 金属性:X>Y,还原性:Z->W2- | B. | 原子半径:X>Y>W>Z | ||
| C. | 离子半径:Y2+<X+<Z-<W2- | D. | 原子序数:Y>X>Z>W |
14.铝热反应为放热反应.常温下,已知:4Al(s)+3O2(g)═2Al2O3(s)△H1,4Fe(s)+3O2(g)═2Fe2O3(s)△H2,下面关于△H1、△H2的比较正确的是( )
| A. | △H1>△H2 | B. | △H1<△H2 | C. | △H1=△H2 | D. | 无法判断 |
1.工业上制备纯Si反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g)△H=+QkJ/mol (Q>0),下列说法正确的是( )
| A. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| B. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/LNaOH恰好反应 | |
| C. | 达平衡后,减小Si的量,有利于平衡正向移动 | |
| D. | 达平衡后,增大压强,可提高SiCl4的转化率 |
11.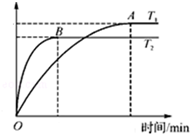 甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
(1)在25℃、101KPa下,1g甲醇(液态)燃烧生成CO2和液态水放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.(△H的数值保留小数点后1位)
(2)工业上用CO与H2反应生成甲醇(催化剂为Cu2O/ZnO).一定条件下,在体积为3L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g).甲醇的物质的量随温度的变化如图所示,请回答下列问题:
①该反应正向为放热反应(填“放热”或“吸热”),升高温度,平衡常数K<(填“增大”、“减小”或“不变”).
②该反应的△S<0(填“>”或“<”)在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
③温度为T2时,从反应开始到平衡,H2表示的平均反应速率v(H2)=$\frac{2nB}{3tB}$mol/(L.min).
④在其他条件不变的情况下,将处于C点的平衡体系体积压缩到原来的1/2,重新平衡时,下列有关该体系的说法正确的是BC.
A. H2的浓度减小 B.甲醇的百分含量增大 C.$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$减小 D.$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大
(3)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆(填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L,该时间内反应速率v(CH3OH)=0.16mol/L.
 甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.(1)在25℃、101KPa下,1g甲醇(液态)燃烧生成CO2和液态水放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.(△H的数值保留小数点后1位)
(2)工业上用CO与H2反应生成甲醇(催化剂为Cu2O/ZnO).一定条件下,在体积为3L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g).甲醇的物质的量随温度的变化如图所示,请回答下列问题:
①该反应正向为放热反应(填“放热”或“吸热”),升高温度,平衡常数K<(填“增大”、“减小”或“不变”).
②该反应的△S<0(填“>”或“<”)在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
③温度为T2时,从反应开始到平衡,H2表示的平均反应速率v(H2)=$\frac{2nB}{3tB}$mol/(L.min).
④在其他条件不变的情况下,将处于C点的平衡体系体积压缩到原来的1/2,重新平衡时,下列有关该体系的说法正确的是BC.
A. H2的浓度减小 B.甲醇的百分含量增大 C.$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$减小 D.$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大
(3)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L,该时间内反应速率v(CH3OH)=0.16mol/L.
18.下列反应对应的离子方程式正确的是( )
| A. | 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| B. | 过氧化钠溶于水:2022-+2H2O=4OH-+O2↑ | |
| C. | 用MnO2从酸化的海带灰中浸取液中提取碘:MnO2+2I-+2H2O=Mn2++I2+4OH- | |
| D. | 向偏铝酸钠溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
15.下列反应的离子方程式书写正确的是( )
| A. | 将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向硫酸铜溶液中加入氢氧化钡溶液:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 将Cu丝插入AgNO3溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 向KHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性:2H++SO${\;}_{4}^{2-}$+Ba2++2OH-═2H2O+BaSO4↓ |
16.下列说法不正确的是(NA为阿伏加德罗常数)( )
| A. | 124 g P4(正四面体结构)含有P-P键的个数为6NA | |
| B. | 18 g NH4+中含有N-H键键长和键能均相同,且个数为4NA | |
| C. | 12 g金刚石中含有C-C键的个数为2NA | |
| D. | 60gSiO2中含Si-O键的个数为2NA |