��Ŀ����
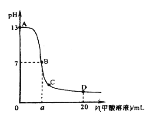
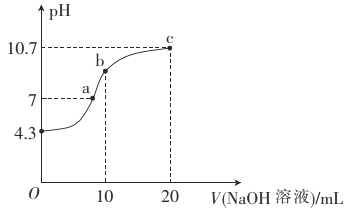
����Ŀ���ⶨ��Һ�絼�ʵı仯�Ƕ����о����������Һ�з�Ӧ���ɵ�һ�ַ�������Һ�絼��Խ���䵼������Խǿ�������£���0.100molL-1��NH3H2O�ζ�10.00mLŨ�Ⱦ�Ϊ0.100molL-1HCl��CH3COOH�Ļ����Һ�����õ絼��������ͼ��ʾ������˵����ȷ���ǣ� ��

A.�ٵ���Һ��pH���
B.��Һ�¶ȣ��ٸ��ڢ�
C.�۵���Һ�У�c(Cl-)��c(CH3COO-)
D.�ڵ���Һ�У�c(NH4+)+c(NH3H2O)��c(CH3COOH)+c(CH3COO-)
���𰸡�C
��������
�����£���0.100molL-1��NH3H2O�ζ�10.00mLŨ�Ⱦ�Ϊ0.100molL-1HCl��CH3COOH�Ļ����Һ��NH3H2O����HCl������Ӧ�����Ȼ�狀�ˮ�������ƶ�������Ŀ���䵫��Һ������絼���½�������10mLNH3H2O��NH3H2O��CH3COOH��Ӧ���ɴ���狀�ˮ������Ϊ������ʶ������Ϊǿ����ʣ��ʷ�Ӧ����Һ�������ƶ�����Ũ�����ӣ��絼�����ߡ�
A�����㴦Ϊ0.100molL-1HCl��CH3COOH�Ļ����Һ������NH3H2O�ĵ��룬pH�����ߣ�A����
B������к�Ϊ���ȷ�Ӧ������Һ�¶�Ϊ������������B����
C����������Ϊ�����ʵ������Ȼ�狀ʹ���泥������������Ϊ��������ӣ�Ҫ����ˮ�⣬��������Һ�У�c(Cl-)��c(CH3COO-)��C��ȷ��
D�����㴦����һˮ�ϰ������ʵ�������Һ�еĴ�������ʵ�����ͬ������Ԫ���غ��֪��c(NH4+)+c(NH3H2O)=c(CH3COOH)+c(CH3COO-)��D����
��ѡC��