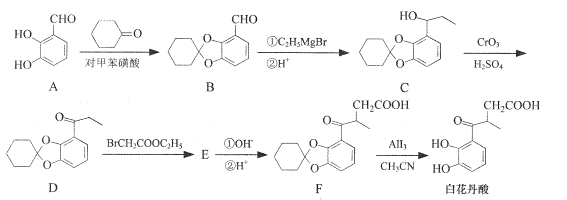
题目内容
【题目】过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:

反应原理![]() 该反应放热.
该反应放热.
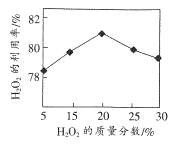
(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如右图所示。5%的H2O2比20%的H2O2利用率低的原因是____。
(2)SrO2.2H2O遇CO2会反应变质,反应的化学方程式为___。
(3)25℃时,将Sr(NO3)2溶液滴加到含有F一、CO32-的溶液中,当混合溶液中c(Sr2+)= 0.0010 mol/L时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=__。
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 moI/L Na2S2O3标准溶液滴定到蓝色恰好消失时,共消耗标准溶液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程__________。(已知:Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9)
【答案】 浓度低的双氧水反应速慢,相同时间内反应的H2O2较少 2SrO2·2H2O+2CO2=2SrCO3+O2↑+4H2O 400 86.67%
【解析】(1) 5%的H2O2比20%的H2O2利用率低的原因是浓度低的双氧水反应速慢,相同时间内反应的H2O2较少;(2)SrO2.2H2O遇CO2会反应变质生成碳酸盐同时放出氧气,反应的化学方程式为2SrO2·2H2O+2CO2=2SrCO3+O2↑+4H2O;(3) Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9)当混合溶液中c(Sr2+)= 0.0010 mol/L时,c(F-)=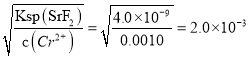 ,c(CO32-)=
,c(CO32-)=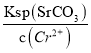 =
=![]() =
=![]() ,c(F-):c(CO32-)=
,c(F-):c(CO32-)=![]() :
:![]() =400;(4)根据物质的关系有:SrO2.2H2O~H2O2~2KI~4Na2S2O3可知,SrO2·2H2O样品的纯度为
=400;(4)根据物质的关系有:SrO2.2H2O~H2O2~2KI~4Na2S2O3可知,SrO2·2H2O样品的纯度为![]() 。
。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案