题目内容
【题目】催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。

①整个过程中FeO的作用是_________。
②写出CO2转化为炭黑的总反应方程式_________。
(2)已知反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。按n(N2)∶n(H2) = 1∶3向反应容器中投料,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:
2NH3(g) ΔH<0。按n(N2)∶n(H2) = 1∶3向反应容器中投料,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:

①下列说法正确的是_________。(填字母)
a.曲线a、b、c对应的温度是由低到高
b.加入催化剂能加快化学反应速率和提高H2的转化率
c.图中Q、M、N点的平衡常数:K(N) > K(Q) = K(M)
②M点对应H2的转化率是_________。
③2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

![]() 、
、![]() 和
和 ![]() 分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是_________和_________。
分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是_________和_________。
(3)有机反应中也常用到催化剂。某反应原理可以用下图表示,写出此反应的化学方程式_________。

【答案】 催化剂 CO2 ![]() C + O2 a 60% N2、H2被吸附在催化剂表面 在催化剂表面,N2、H2分子中化学键断裂
C + O2 a 60% N2、H2被吸附在催化剂表面 在催化剂表面,N2、H2分子中化学键断裂 
【解析】(1).由图像知①整个过程中FeO的作用是催化剂。
②CO2转化为炭黑的总反应方程式:CO2 ![]() C + O2。
C + O2。
(2)①因为正反应是放热反应, 相同压强下,投料相同升高温度平衡逆向移动,氨气的含量减小,而a点氨的体积分数最大,依次知曲线温度,cba的温度依次降低,故a正确; b.加入催化剂能加快化学反应速率但不能改变平衡移动,所以提高H2的转化率是错的,故b错;c、K只受温度影响,温度不变平衡常数不变,所以K(Q)=K(N),正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,Q点的温度低于N,所以K(Q)>K(N),故错误。答案:a。
②根据反应 ![]()
![]()
起始量(mol) 13 0
转化量(mol) a3a2a
平衡量(mol) 1-a3-3a 2a
根据题意有M点氨气的质量分数为60![]() 。所以有(2a
。所以有(2a![]() /
/ ![]() =60
=60![]() a=0.6mol
a=0.6mol
M点对应H2的转化率是(0.6![]() =60
=60![]()
③由e表示生成的NH3离开催化剂表面,知b的含义是N2、H2被吸附在催化剂表面。c的含义是在催化剂表面,N2、H2分子中化学键断裂。
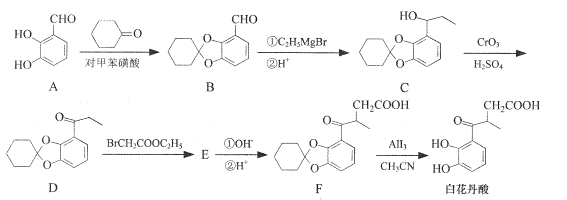
(3)由图可知有机反应中催化剂反应原理化学方程式为

【题目】人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大最的热。氢气燃烧生成水蒸气的能最变化如下图所示:

根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着______变化,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是_______kJ。
(2)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

a.电流计指针偏转 |
b.Cu极有H2产生 |
c.H+向负极移动 |
d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是_______(填序号)。
②请写出该电池的负极反应式_________。
③若有1mol电子流过导线,则理论上产生H2的质量为______g.
④将稀H2SO4换成CuSO4溶液,电极质量增加的是______(填“锌极”或“铜极”,下同),溶液中SO42-移向_______。
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= .
(2)该反应为反应(选填“吸热”、“放热”).
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2molL﹣1、2molL﹣1、4molL﹣1、4molL﹣1 , 则此时上述反应的平衡移动方向为 . (选填“正反应方向”、“逆反应方向”、“不移动”)