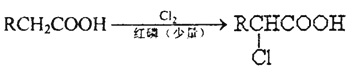题目内容
【题目】学生用0.1000molL﹣1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分为: A.取20.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2﹣3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2﹣3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2﹣3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管的读数.
回答下列问题:
(1)正确的操作顺序是:B、、F(填序号);
(2)上述B步骤操作的目的是;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是 (填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是;
(5)若滴定结束时,滴定管液面如图所示,则终点读数为mL. ![]()
(6)根据读数计算出该待测液的浓度为 .
【答案】
(1)DCEA
(2)防止滴定管内壁附着的水将标准溶液稀释而带来误差
(3)偏大
(4)溶液由无色变为浅红色,且半分钟内不褪色
(5)21.10
(6)0.0900mol?L﹣1
【解析】解:(1)中和滴定按照检漏、洗涤、润洗、装液、滴定等顺序操作,所以答案是:D C E A;(2)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2﹣3次,所以答案是:防止滴定管内壁附着的水将标准溶液稀释而带来误差;(3)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(碱)偏大,根据c(酸)= ![]() ,会造成结果偏高,所以答案是:偏大;(4)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,所以答案是:溶液由无色变为浅红色,且半分钟内不褪色;(5)滴定管的刻度由上而下刻度增大,精度为0.01mL,由图可知终点读数为21.10mL,所以答案是:21.10;(6)C(HCl)=
,会造成结果偏高,所以答案是:偏大;(4)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,所以答案是:溶液由无色变为浅红色,且半分钟内不褪色;(5)滴定管的刻度由上而下刻度增大,精度为0.01mL,由图可知终点读数为21.10mL,所以答案是:21.10;(6)C(HCl)= ![]() =
= ![]() =0.0900molL﹣1,所以答案是:0.0900molL﹣1.
=0.0900molL﹣1,所以答案是:0.0900molL﹣1.
【考点精析】认真审题,首先需要了解酸碱中和滴定(中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点).

【题目】亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂,同时也是对烟气进行脱硫、脱硝的吸收剂。
Ⅰ.以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:

已知:
i.纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
ii.NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
iii.NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,等于或高于38℃时析出NaClO2晶体,高于60℃时分解成NaClO3和NaCl。
(1)试剂A应选择_________。(填字母)
a.SO2 b.浓硝酸 c.KMnO4
(2)反应②的离子方程式为_________。
(3)已知压强越大,物质的沸点越高。反应②结束后采用“减压蒸发”操作的原因是________。
(4)下列关于上述流程的说法中,合理的是_________。(填字母)
a.反应①进行过程中应持续鼓入空气
b.反应①后得到的母液中,溶质的主要成分是NaCl
c.反应②中NaOH溶液应过量
d.冷却结晶时温度选择38℃,过滤后进行温水洗涤,然后在低于60℃下进行干燥,得到粗产品NaClO2
Ⅱ.采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
(5)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol/L。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c /(mol/L) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________。
②由实验结果可知,脱硫反应速率_________(填“大于”或“小于”)脱硝反应速率。除SO2和NO在烟气中的初始浓度不同外,还可能存在的原因是_________。(答出两条即可)