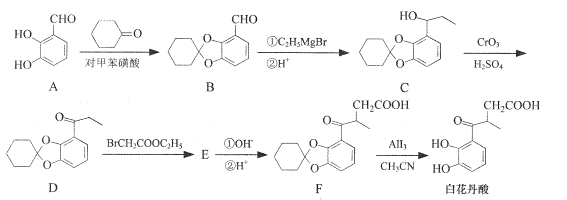
题目内容
【题目】根据海水综合利用的工业流程图,判断下列说法不正确的是( )

A. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
B. 在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 从能量转换角度看,氯碱工业电解饱和食盐水是一个将电能转化为化学能的过程
D. 从第④步到第⑤步的目的是富集Br2
【答案】B
【解析】A、除去粗盐中Mg2+,常用NaOH,除去SO42-,常用BaCl2,除去Ca2+,常用Na2CO3,Na2CO3的作用不仅是除去Ca2+,还要除去过量的BaCl2,因此Na2CO3放在BaCl2的后面,即顺序是NaOH、BaCl2、Na2CO3或者BaCl2、NaOH、Na2CO3或者BaCl2、Na2CO3、NaOH,然后过滤,再加盐酸,除去过量的NaOH和Na2CO3,故A说法正确;B、灼烧MgCl2·6H2O时,需要在HCl氛围中加热,防止Mg2+水解,故B说法正确;C、电解饱和食盐水,此装置为电解池,是电能转化为化学能,故C说法正确;D、海水中Br-浓度低,从④步到⑤步,目的是富集Br2,故D说法正确。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大最的热。氢气燃烧生成水蒸气的能最变化如下图所示:

根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着______变化,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是_______kJ。
(2)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

a.电流计指针偏转 |
b.Cu极有H2产生 |
c.H+向负极移动 |
d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是_______(填序号)。
②请写出该电池的负极反应式_________。
③若有1mol电子流过导线,则理论上产生H2的质量为______g.
④将稀H2SO4换成CuSO4溶液,电极质量增加的是______(填“锌极”或“铜极”,下同),溶液中SO42-移向_______。