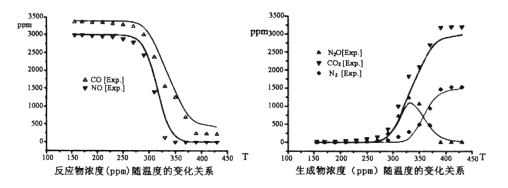
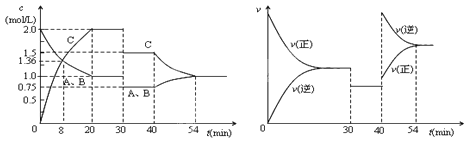
题目内容
【题目】某同学设计如图所示实验,探究反应中的能量变化。
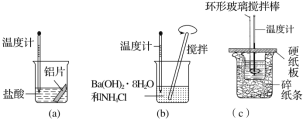
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响
D.若用NaOH固体测定中和热,则测定中和热的数值偏高
【答案】D
【解析】
A. (a)是金属与酸的反应,是放热反应;(b)是氢氧化钡晶体与氯化铵反应,属于吸热反应; (c) 酸碱中和反应是放热反应;因此放热反应只有(a)和(c),A项错误;
B. 铝粉和铝片本质一样,放出热量不变,只是铝粉参与反应,速率加快,B项错误;
C. 相较于环形玻璃搅拌棒,铁质搅拌棒导热快,会造成热量损失,对实验结果有影响,C项错误;
D. 氢氧化钠固体溶解时要放出热量,最终使测定中和热的数值偏高,D项正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应。他们设计了下图装置![]() 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好![]() 进行实验,探究Na2O2与SO2反应的产物,请按要求回答下列问题。
进行实验,探究Na2O2与SO2反应的产物,请按要求回答下列问题。
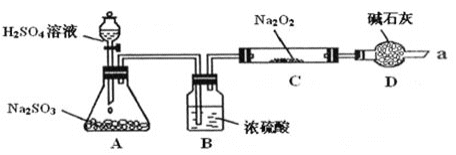
⑴写出装置A中发生反应的化学方程式:_________
⑵装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以__________。
⑶在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;
假设2:_________;
假设3:既有Na2SO3,又有Na2SO4。
a、为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理__________![]() 填“是”或“否”
填“是”或“否”![]() ,理由是_______。
,理由是_______。
b、若假设2成立,写出SO2与Na2O2反应的化学方程式:_________。
c、乙同学设计了如下实验进一步确认产物的成分。
实验步骤 | 现象 |
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解。 | 固体全部溶解 |
②向上试管中加入过量的稀盐酸,将生成的气体通入少量酸性KMnO4溶液中。 | 酸性KMnO4溶液褪色 |
③向步骤②反应后的试管中,加入适量的BaCl2溶液。 | 产生白色沉淀 |
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为: ________,通过上述实验现象确定假设__________成立。(选填1、2或3)。