题目内容
【题目】氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。
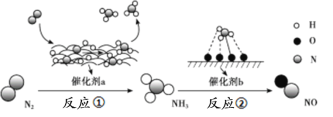

下列分析合理的是
A.如图中c曲线是加入催化剂a时的能量变化曲线
B.反应①的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D.催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率
【答案】B
【解析】
A. 使用催化剂能够降低反应的活化能,加快反应速率,所以曲线d是加入催化剂a时的能量变化曲线,A错误;
B. 根据图示可知反应物比生成物的能量高出600 kJ-508 kJ=92 kJ,故反应①的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol,B正确;
2NH3(g) ΔH=-92 kJ/mol,B正确;
C. 未指明气体所处条件,因此不能根据电子转移的物质的量确定气体的体积,C错误;
D. 催化剂能加快化学反应的反应速率,但不能使化学平衡发生移动,因此不能改变物质的平衡转化率,D错误;
故合理选项是B。

 名校课堂系列答案
名校课堂系列答案【题目】为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。
已知:① CO(g)+![]() O2(g) = CO2 (g) △H=-283kJ·mol-1
O2(g) = CO2 (g) △H=-283kJ·mol-1
② H2(g)+![]() O2(g) = H2O (g) △H=-241.8kJ·mol-1
O2(g) = H2O (g) △H=-241.8kJ·mol-1
③ H2O (l)=H2O (g) △H=+44.0kJ·mol-1
(1)H2的燃烧热△H=________。
(2)写出CO(g)和H2O (g)作用生成CO2 (g)和H2(g)的热化学方程式:________。
(3)相关物质的化学键键能数据如下:
化学键 | O=O(O2) | H—H | H—O |
E/(kJ·mol-1) | x | 436 | 463 |
计算x=________kJ·mol-1。
(4)某反应2X(g)+Y(g)2Z(g) △H= -Q kJ·mol-1,反应过程中能量变化如图所示,其中虚线表示加入催化剂M时的情况。
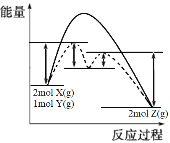
①加入催化剂M后,△H________ (填“改变”或“不变”)。
②在使用催化剂的两部反应中,________ (填“第一步”或“第二步”)决定反应速率。
【题目】下列实验操作、现象、结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向 | 上层液体呈橙红色 | 氧化性: |
B | 向 | 白色沉淀不溶解 |
|
C | 向盛有 | 溶液变蓝绿色,试管底有红色沉淀 | 氧化性: |
D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化的铝滴落 | 生成 |
A.AB.BC.CD.D
【题目】(1)100°C时,KW=1.0×10-12,在该温度下,测得0.1mol/L Na2A溶液pH=6。
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2_____(填“多”、“少”或“一样多”)。
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A)_____c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A)_____0.2mol/L。
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c(CH3COO-)-c(CH3COOH)=_____mol/L(填准确数值)。