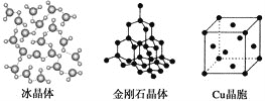
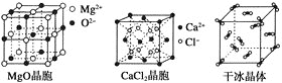
题目内容
【题目】下列图示与对应的叙述错误的是

A. 图甲表示分别用NaOH溶液滴定等浓度等体积的盐酸和醋酸溶液反应变化曲线,指示剂都可用酚酞
B. 图乙表示分别用等浓度AgNO3溶液滴定等浓度等体积的NaCl、NaBr及NaI溶液反应变化曲线(X-表示Cl-、Br-、I-),则c为I–(溶度积常数:Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl))
C. 图丙表示一定温度下,水溶液中H+和OH-的浓度变化曲线,b→a可能是加CuCl2溶液导致的
D. 图丁表示其他条件不变时,可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0 , C的物质的量分数与温度的关系
2C(g) ΔH<0 , C的物质的量分数与温度的关系
【答案】B
【解析】
A.醋酸是弱电解质,相同浓度的醋酸溶液的pH大于盐酸溶液的pH,所以图甲表示分别用NaOH溶液滴定等浓度等体积的盐酸和酷酸溶液反应变化曲线,终点时两溶液分别显碱性和中性,因此指示剂都可用酚酞,选项A正确;
B.碘化银的溶度积常数最小,到达滴定终点后,碘离子的浓度最小,其负对数最大,因此图乙表示分别用等浓度AgNO3溶液滴定等浓度等体积的NaCl 、NaBr及NaI溶液反应变化曲线,图中a为I-,选项B错误;
C.氯化铜溶于水铜离子水解溶液显酸性,促进水的电离,图丙表示一定温度下,水溶液中H+和OH-的浓度变化曲线,b→a可能是加CuCl2溶液导致的,选项C正确;
D.T2首先达到平衡状态,温度是T2大于T1,温度高C的含量小,说明升高温度平衡向逆反应方向进行,正反应是放热反应,选项D正确。
答案选B。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。

请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为___(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式);请设计实验验证装置C中生成的盐中含有SO42-:____。
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+ O2(g)![]() 2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
实验编号 | 温度/℃ | 平衡常数/mol-1·L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. T1、T2的关系:T1 > T2
B. x= 1.6,y=0.2 ,t<6
C. K1、K2的关系:K2>K1
D. 实验1在前6min的反应速率υ(SO2)=0.2 mol·L-1·min-1
【题目】(16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①反应的平衡常数表达式为K= 。由上表数据判断,该反应的△H 0(填“>”、“=”或“<”)。升高温度,正反应速率 (填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为 ,此时的温度为 。
(3)欲提高CO的转化率,可采取的措施是 。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
体系压强(Pa) | p1 | p2 | p3 | |
反应的能量变化 | akJ | bkJ | ckJ | |
原料转化率 | α1 | α2 | α3 | |
下列分析正确的是 。(填序号)
A.2c1<c3 B.2 p1<p3C.|a|+|b|=90.8 D.α1+α3>1