题目内容
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol过氧化钠中阴离子所带的负电荷数为NA
B.14 g乙烯和丙烯的混合物中含有的碳原子的数目为NA
C.28 g C16O与28 g C18O中含有的质子数均为14 NA
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
【答案】B
【解析】
A.1 mol过氧化钠(Na2O2)中阴离子(O22-)所带的负电荷数应为2NA,A不正确;
B.乙烯和丙烯的最简式都是CH2,故14 g中混合物所含的碳原子数为![]() =1mol,即碳原子数目为NA,B正确;
=1mol,即碳原子数目为NA,B正确;
C.28 g C16O的物质的量为1mol,含有的质子数为1mol×(6+8)×NA =14 NA,28 g C18O的物质的量为![]() =
=![]() mol,即质子数为14×
mol,即质子数为14×![]() NA<14 NA,C不正确;
NA<14 NA,C不正确;
D.由Cl2+2NaOH=NaCl+NaClO+H2O可知,标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为NA,D不正确;
故答案选B。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。
已知:① CO(g)+![]() O2(g) = CO2 (g) △H=-283kJ·mol-1
O2(g) = CO2 (g) △H=-283kJ·mol-1
② H2(g)+![]() O2(g) = H2O (g) △H=-241.8kJ·mol-1
O2(g) = H2O (g) △H=-241.8kJ·mol-1
③ H2O (l)=H2O (g) △H=+44.0kJ·mol-1
(1)H2的燃烧热△H=________。
(2)写出CO(g)和H2O (g)作用生成CO2 (g)和H2(g)的热化学方程式:________。
(3)相关物质的化学键键能数据如下:
化学键 | O=O(O2) | H—H | H—O |
E/(kJ·mol-1) | x | 436 | 463 |
计算x=________kJ·mol-1。
(4)某反应2X(g)+Y(g)2Z(g) △H= -Q kJ·mol-1,反应过程中能量变化如图所示,其中虚线表示加入催化剂M时的情况。
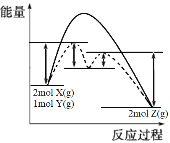
①加入催化剂M后,△H________ (填“改变”或“不变”)。
②在使用催化剂的两部反应中,________ (填“第一步”或“第二步”)决定反应速率。
【题目】(1)100°C时,KW=1.0×10-12,在该温度下,测得0.1mol/L Na2A溶液pH=6。
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2_____(填“多”、“少”或“一样多”)。
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A)_____c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A)_____0.2mol/L。
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c(CH3COO-)-c(CH3COOH)=_____mol/L(填准确数值)。