题目内容
19.某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出.为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:Ⅰ.有关资料:铜的化合物颜色性质如下
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,按照AECBFD的顺序连接下列装置进行实验,验证阴极产物,实验前,检查装置A气密性的方法是将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性好(其他合理答案也可).
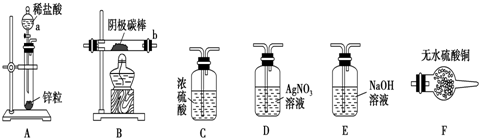
(3)观察现象,得出结论;
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象回答:
①碳棒上的红色物质是否有Cu2O否(填“是”或“否”),理由是F中物质不变蓝色;
②上述装置D中出现白色沉淀的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
(4)问题讨论
①关于电解CuCl2溶过程中,电解液的pH变化,一种观点从理论上分析认为是逐渐增大,你觉得支持这一说法的理由是(结合方程式回答)a:a中由于Cu2++2H2O?Cu(OH)2+2H+,电解使Cu2+浓度减小,水解平衡逆向移动,溶液酸性减弱,pH增大.
另一同学用pH试纸测定其电解前后变化,结果发现是在减小,你觉得原因是b:b中电解产生的氯气溶于水,使水溶液酸性增强,pH减小.
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是氢气和氧气混合加热可能发生爆炸;空气中水蒸气会干扰Cu2O是否存在的判断.
分析 (1)由Cu的化合物的颜色可知,CuCl为白色固体;
(2)利用装置不漏气检验装置的气密性;
(3)无水硫酸铜不变色说明阴极碳棒上的产物与氢气反应产物中没有水;由实验现象分析理由;
根据CuCl与氢气反应生成了氯化氢,通过检验氯离子判断是否存在CuCl;
③装置b中发生反应的化学方程式为氯化亚铁与氢气反应生成铜和氯化氢;
(4)①铜离子水解生成氢离子,电解过程中析出Cu而抑制其水解;
阳极生成的氯气溶解于溶液中生成酸;
②氢气和氧气混合加热会产生爆炸;空气中含有水蒸气,影响H元素检验.
解答 解:(1)由Cu的化合物的颜色可知,CuCl为白色固体,故答案为:CuCl;
(2)利用装置不漏气检验装置的气密性,其方法为将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗的活塞,水的液面不会连续下降,证明装置A的气密性好,
故答案为:将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗的活塞,水的液面不会连续下降,证明装置A的气密性好;
(3)①由于无水硫酸铜不变色,证明中b反应产物没有水生成,碳棒上的红色物质中没有氧元素,一定不会含有氧化亚铜,
故答案为:否;F中物质不变蓝色;
②假设②中,白色物质若为CuCl,CuCl与氢气反应会生成氯化氢,将生成产物通入硝酸银溶液中,若D中生成了白色沉淀,证明白色物质为CuCl,
故答案为:D中出现白色沉淀;
③装置b中发生反应为CuCl与氢气反应,反应的化学方程式为:2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl,故答案为:2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl;
(3)①电解CuCl2溶液时,阴极上发生的反应为Cu2++2e-=Cu,且生成氯化亚铜发生2Cu2++2e-+2Cl-=2CuCl,
故答案为:Cu2++2e-=Cu,2Cu2++2e-+2Cl-=2CuCl;
②用若装置b中的空气没有排净就开始加热,氢气和氧气混合加热可能爆炸,且空气中水蒸气会干扰Cu2O是否存在的判断,故答案为:氢气和氧气混合加热可能爆炸,且空气中水蒸气会干扰Cu2O是否存在的判断.
(4)①a中由于Cu2++2H2O?Cu(OH)2+2H+,电解使Cu2+浓度减小,水解平衡逆向移动,溶液酸性减弱,pH增大;
b中电解产生的氯气溶于水,使水溶液酸性增强,pH减小,
故答案为:a中由于Cu2++2H2O?Cu(OH)2+2H+,电解使Cu2+浓度减小,水解平衡逆向移动,溶液酸性减弱,pH增大;
b中电解产生的氯气溶于水,使水溶液酸性增强,pH减小;
②氢气和氧气混合加热可能产生爆炸现象,空气中含有水蒸气,从而干扰Cu2O是否存在的判断,
故答案为:氢气和氧气混合加热可能发生爆炸;空气中水蒸气会干扰Cu2O是否存在的判断.
点评 本题考查探究实验,涉及实验基本操作、物质性质等知识点,明确实验原理、实验安全及物质性质是解本题关键,侧重考查学生知识综合应用及解决问题、实验操作能力,难点是(4)①中溶液pH变化原因.

| A. | $\frac{1}{5}$mol | B. | 2mol | C. | 3 mol | D. | 6mol |
| A. |  | B. |  | C. |  | D. |  |
| A. | Al3+ | B. | NH4+ | C. | Fe3+ | D. | Fe2+ |
 )4种有机物分别在一定条件下与H2充分反应.
)4种有机物分别在一定条件下与H2充分反应.