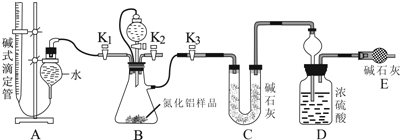
题目内容
10.加热12.6克的NaHCO3到没有气体放出时,剩余物质是什么,计算其质量?分析 NaHCO3不稳定,受热易分解,反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,根据方程式知,NaHCO3完全分解时最终得到的物质是Na2CO3,根据NaHCO3和Na2CO3之间的关系式计算.
解答 解:NaHCO3不稳定,受热易分解,反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,根据方程式知,NaHCO3完全分解时最终得到的物质是Na2CO3,
设生成的Na2CO3质量是x,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
168g 106g
12.6g x
168g:106g=12.6g:x
x=$\frac{106g×12.6g}{168g}$=7.95g
答:剩余物质是碳酸钠,其质量为7.95g.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间关系是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL 0.3mol•L-1的NaCl溶液和300mL 0.2mol•L-1的AgNO3溶液,当产生0.56L(标况)Cl2时,停止电解,取出电极,将两杯溶液混合,混合液的pH为(混合后溶液体积为500mL)( )
| A. | 1.4 | B. | 5.6 | C. | 7 | D. | 12.6 |
1.下列说法中,正确的是( )
| A. | 提出原子学说,为近代化学的发展奠定了坚实基础的科学家是拉瓦锡 | |
| B. | 化学的特征就是认识分子和制造分子 | |
| C. | 在化学反应中,反应物的物质的量之和一定等于生成物的物质的量之和 | |
| D. | 英国科学家道尔顿提出元素周期律,把化学元素及其化合物纳入一个统一的理论体系 |
18.下列叙述中正确的是( )
①标准状况下,1L HCl和1L H2O的物质的量相同;
②标准状况下,11.2L H2和14g N2所含原子数相同;
③28g CO的体积约为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比.
①标准状况下,1L HCl和1L H2O的物质的量相同;
②标准状况下,11.2L H2和14g N2所含原子数相同;
③28g CO的体积约为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比.
| A. | 仅⑤⑥ | B. | 仅②⑤⑥ | C. | 仅②③⑤⑥ | D. | 仅①②④⑤⑥ |
5.取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
| A. | 3.6mol/L | B. | 3.2mol/L | C. | 2.8mol/L | D. | 2.4mol/L |
19.某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出.为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.有关资料:铜的化合物颜色性质如下
Ⅱ.探究实验:
(1)提出假设
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,按照AECBFD的顺序连接下列装置进行实验,验证阴极产物,实验前,检查装置A气密性的方法是将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性好(其他合理答案也可).
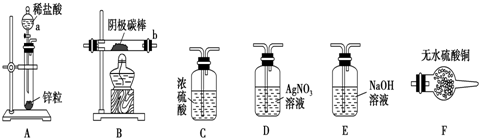
(3)观察现象,得出结论;
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象回答:
①碳棒上的红色物质是否有Cu2O否(填“是”或“否”),理由是F中物质不变蓝色;
②上述装置D中出现白色沉淀的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
(4)问题讨论
①关于电解CuCl2溶过程中,电解液的pH变化,一种观点从理论上分析认为是逐渐增大,你觉得支持这一说法的理由是(结合方程式回答)a:a中由于Cu2++2H2O?Cu(OH)2+2H+,电解使Cu2+浓度减小,水解平衡逆向移动,溶液酸性减弱,pH增大.
另一同学用pH试纸测定其电解前后变化,结果发现是在减小,你觉得原因是b:b中电解产生的氯气溶于水,使水溶液酸性增强,pH减小.
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是氢气和氧气混合加热可能发生爆炸;空气中水蒸气会干扰Cu2O是否存在的判断.
Ⅰ.有关资料:铜的化合物颜色性质如下
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,按照AECBFD的顺序连接下列装置进行实验,验证阴极产物,实验前,检查装置A气密性的方法是将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性好(其他合理答案也可).

(3)观察现象,得出结论;
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象回答:
①碳棒上的红色物质是否有Cu2O否(填“是”或“否”),理由是F中物质不变蓝色;
②上述装置D中出现白色沉淀的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
(4)问题讨论
①关于电解CuCl2溶过程中,电解液的pH变化,一种观点从理论上分析认为是逐渐增大,你觉得支持这一说法的理由是(结合方程式回答)a:a中由于Cu2++2H2O?Cu(OH)2+2H+,电解使Cu2+浓度减小,水解平衡逆向移动,溶液酸性减弱,pH增大.
另一同学用pH试纸测定其电解前后变化,结果发现是在减小,你觉得原因是b:b中电解产生的氯气溶于水,使水溶液酸性增强,pH减小.
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是氢气和氧气混合加热可能发生爆炸;空气中水蒸气会干扰Cu2O是否存在的判断.
20.近年来,科技人员又研究得到一种新型材料--泡沫铝.它是由发泡剂加到熔融或固体粉末的铝合金(合金是指金属跟其他金属或非金属所组成的具有金属特性的物质)中而制成的,其优点是硬度高,密度小(约为0.16~0.5g•cm-3),比木材还轻,可浮于水面,又有很大刚性,且隔音、保温,是一种良好的建筑材料和轻质材料,近几年就可大批量投放市场,则下列关于泡沫铝的说法错误的是( )
| A. | 泡沫铝是纯净物 | |
| B. | 泡沫铝是一种合金 | |
| C. | 泡沫铝是一种优质的建筑材料和轻质材料 | |
| D. | 泡沫铝可用于飞机制造 |