题目内容
2.I.某反应为:4CuI+Hg═Cu2HgI4+2Cu(反应前后的I均为-1价),试回答:①上述反应产物Cu2HgI4中,Hg元素显+2价;
②CuI发生还原反应(填氧化或还原).
Ⅱ.某反应为:3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O
①反应中氧化剂是H2O2(填化学式),被氧化的元素Cr(填元素符号);
②用单线桥表示出该反应中电子转移的方向和数目
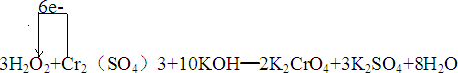 .
. Ⅲ.有下列三个反应:
a.2FeCl2+2KI═2FeCl2+2KCl+I2
b.2FeCl2+Cl2═2FeCl3
c.2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
①上述三个反应中氧化剂氧化性强弱关系为KMnO4>Cl2 >FeCl3;
②在反应c中,若被氧化的HCl为1.5mol,则转移的电子数是1.5NA.
分析 Ⅰ、①Cu2HgI4中,反应前后的I均为-1价,Cu元素的化合价为+1价,则依据化合价代数和为0计算Hg元素的化合价为+2价;
②CuI中铜元素化合价+1价变化为0价,化合价降低做氧化剂被还原;
Ⅱ、①元素化合价降低的反应物做氧化剂被还原,元素化合价升高的反应物做还原剂被氧化;
②单线桥是指从失去电子的一方指向得到电子的一方,上面标注电子转移总数,此反应中铬元素化合价+3价变化为+4价,被氧化电子转移6e-;
Ⅲ、①氧化剂的氧化性大于氧化产物,据此分析三个反应中的关系得到;
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中被氧化10molHCl电子转移10mol计算.
解答 解:Ⅰ、①Cu2HgI4中,反应前后的I均为-1价,则依据化合价代数和为0,Cu元素的化合价为+1价,计算Hg元素的化合价为+2价,故答案为:+2;
②分析反应可知,4CuI+Hg═Cu2HgI4+2Cu中CuI中的铜元素化合价+1价变化为0价,化合价降低做氧化剂被还原,故答案为:还原;
Ⅱ、①元素化合价降低的反应物做氧化剂被还原,元素化合价升高的反应物做还原剂被氧化,反应3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O,反应中Cr元素化合价+3价变化为+4价,元素化合价升高失电子做还原剂被氧化,发生氧化反应,过氧化氢中氧元素化合价-1价变化为-2价,化合价降低得到电子做氧化剂被还原,发生还原反应,
故答案为:H2O2;Cr;
②单线桥是指从失去电子的一方指向得到电子的一方,上面标注电子转移总数,此反应中铬元素化合价+3价变化为+4价,被氧化电子转移6e-,用单线桥表示出该反应中电子转移的方向和数目的化学方程式为: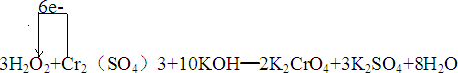 ,
,
故答案为: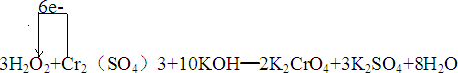 ;
;
Ⅲ、①氧化剂的氧化性大于氧化产物,则
a.2FeCl3+2KI═2FeCl2+2KCl+I2,氧化剂FeCl3 ,氧化产物I2,氧化性FeCl3 >I2,
b.2FeCl2+Cl2═2FeCl3,氧化剂Cl2,氧化产物FeCl3,氧化性Cl2>FeCl3,
c.2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,氧化剂KMnO4,氧化产物Cl2,氧化性KMnO4>Cl2,
氧化剂氧化性强弱关系为KMnO4>Cl2 >FeCl3,
故答案为:KMnO4>Cl2 >FeCl3;
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中被氧化10molHCl电子转移10mol,若被氧化的HCl为1.5mol,则转移的电子数是1.5NA,
故答案为:1.5NA.
点评 本题考查了氧化还原反应中的功能分析,电子转移计算,氧化性强弱比较,注意掌握基本概念实质和规律的应用是解题关键,题目难度中等.

| A. | 氯化钡与硫酸钠,氢氧化钡与硫酸 | |
| B. | 碘化钾与氯气,溴化钾与氯气 | |
| C. | 碳酸银与盐酸,硝酸银与盐酸 | |
| D. | 碳酸氢钠与稀硫酸,碳酸氢钾与盐酸 |
| A. | 当Al3+恰好完全沉淀时,消耗氢氧化钡1.5mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5mol氢氧化钡时,反应可用下列离子方程式表示:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| D. | 反应过程中随加入的氢氧化钡的物质的量不断增大,沉淀的质量不断增大 |
| A. | MgO | B. | FeCl2 | C. | CO | D. | H2O |
| A. | N2 | B. | O2 | C. | H2O | D. | CO2 |
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | 该反应的平衡常数表达式为:K=[c(CH3OCH3)×c(H2O)]/c(CH3OH) | |
| B. | 此时正、逆反应速率的大小:v正<v逆 | |
| C. | 若加入CH3OH后,经10 min达到平衡,此时c(CH3OH)=0.04 mol/L | |
| D. | 10 min达到平衡时,反应速率v(CH3OH)=1.6 mol/(L•min) |
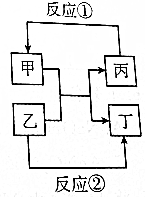 甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题:
甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题: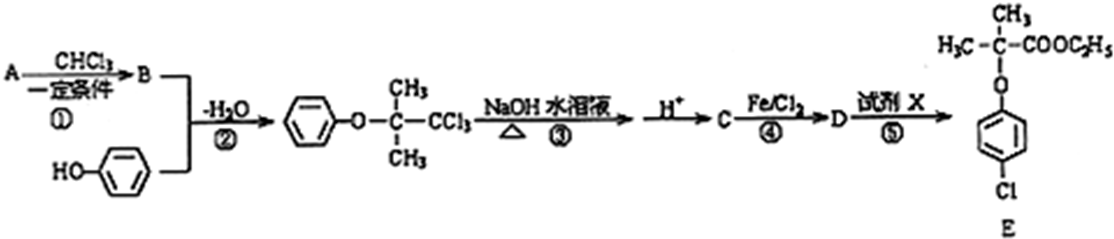
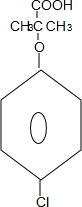 .
.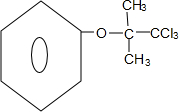 +4NaOH$→_{△}^{H_{2}O}$
+4NaOH$→_{△}^{H_{2}O}$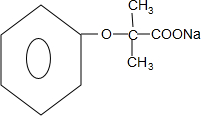 +3NaCl+2H2O.
+3NaCl+2H2O.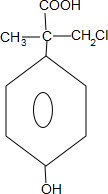 .
.