题目内容
15.某种用于治疗高脂蛋白血症的药物E可以用如下所示方法合成.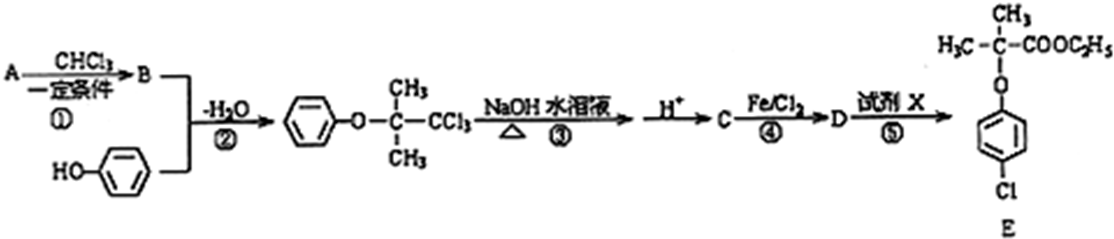
已知:反应①符合“绿色化学”的原则,原子利用率达到100%;同一个碳原子上连有两个或多个羟基时结构不稳定,易脱水形成羰基.
(1)A分子中含有的官能团名称为羰基;反应⑤的条件为浓硫酸、加热.
(2)写出物质D的结构简式
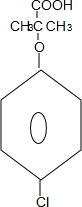 .
.(3)写出反应③的化学方程式
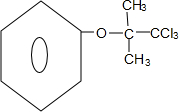 +4NaOH$→_{△}^{H_{2}O}$
+4NaOH$→_{△}^{H_{2}O}$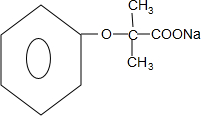 +3NaCl+2H2O.
+3NaCl+2H2O.(4)D的同分异构体有多种,其中含有羟基和酚羟基且同时符合下列条件的共4种.其中有一种在NaOH乙醇溶液中不能发生消去反应,其结构简式为
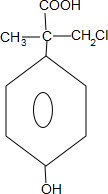 .
.①苯环上有2个对位的取代基,且苯环上的一溴取代物只有2种;
②与NaOH溶液发生取代反应所形成的官能团被氧化后可发生银镜反应.
分析 反应①符合“绿色化学”的原则,原子利用率达到100%,结合B与苯酚反应的产物可知.A为 ,A与3氯甲烷反应生成的B为CH3(CH3)C(OH)CCl3,反应③是氯素原子在NaOH的水溶液中的水解反应,同一个碳原子上连有两个或多个羟基时结构不稳定,易脱水形成羰基,酸化后生成的C中含有-COOH,结合E的结构简式可知反应④是在苯环上引入Cl原子的反应,生成的D为
,A与3氯甲烷反应生成的B为CH3(CH3)C(OH)CCl3,反应③是氯素原子在NaOH的水溶液中的水解反应,同一个碳原子上连有两个或多个羟基时结构不稳定,易脱水形成羰基,酸化后生成的C中含有-COOH,结合E的结构简式可知反应④是在苯环上引入Cl原子的反应,生成的D为 ,D与乙醇发生酯化反应生成E,据此分析.
,D与乙醇发生酯化反应生成E,据此分析.
解答 解:反应①符合“绿色化学”的原则,原子利用率达到100%,结合B与苯酚反应的产物可知.A为 ,A与3氯甲烷反应生成的B为CH3(CH3)C(OH)CCl3,反应③是氯素原子在NaOH的水溶液中的水解反应,同一个碳原子上连有两个或多个羟基时结构不稳定,易脱水形成羰基,酸化后生成的C中含有-COOH,结合E的结构简式可知反应④是在苯环上引入Cl原子的反应,生成的D为
,A与3氯甲烷反应生成的B为CH3(CH3)C(OH)CCl3,反应③是氯素原子在NaOH的水溶液中的水解反应,同一个碳原子上连有两个或多个羟基时结构不稳定,易脱水形成羰基,酸化后生成的C中含有-COOH,结合E的结构简式可知反应④是在苯环上引入Cl原子的反应,生成的D为 ,D与乙醇发生酯化反应生成E,
,D与乙醇发生酯化反应生成E,
(1)反应①符合“绿色化学”的原则,原子利用率达到100%,结合B与苯酚反应的产物可知.A为 ,含有羰基官能团,反应⑤是D与乙醇发生酯化反应,反应条件是浓硫酸、加热,故答案为:羰基;浓硫酸、加热;
,含有羰基官能团,反应⑤是D与乙醇发生酯化反应,反应条件是浓硫酸、加热,故答案为:羰基;浓硫酸、加热;
(2)据分析可知D为 ,故答案为:
,故答案为: ;
;
(3)反应③是氯素原子在NaOH的水溶液中的水解反应,同一个碳原子上连有两个或多个羟基时结构不稳定,易脱水形成羰基,可知反应方程式为 +4NaOH$→_{△}^{H_{2}O}$
+4NaOH$→_{△}^{H_{2}O}$ +3NaCl+2H2O,
+3NaCl+2H2O,
故答案为: +4NaOH$→_{△}^{H_{2}O}$
+4NaOH$→_{△}^{H_{2}O}$ +3NaCl+2H2O;
+3NaCl+2H2O;
(4)D的同分异构体中含有羧基和酚羟基且同时符合①苯环上有2个对位的取代基,且苯环上的一溴取代物只有2种;说明苯环上有酚羟基和另一官能团,且在对位,
②与NaOH溶液发生取代反应所形成的官能团被氧化后可发生银镜反应,说明另一官能团中含有-CH2Cl结构,可能的结构有-CH2CH(CH2Cl)COOH,-CH(CH2Cl)CH2COOH,-CH(COOH)CH2CH2Cl, 共4种,其中在NaOH乙醇溶液中不能发生消去反应为
共4种,其中在NaOH乙醇溶液中不能发生消去反应为 ,故答案为:4;
,故答案为:4; .
.
点评 本题考查了有机推断和有机化学方程式的书写以及同分异构体的判断,同分异构体的判断是难点,注意根据官能团的性质以及反应条件判断反应,充分利用题目所给信息是解题的关键.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | 溶液、胶体、浊液 | B. | 浊液、胶体、溶液 | C. | 胶体、浊液、溶液 | D. | 浊液、溶液、胶体 |
| A. | 不能使用酒精作为萃取剂,因为溴单质在酒精中的溶解度比在水中的小 | |
| B. | 静置分层后有色层在下层,水层几乎无色 | |
| C. | 分液漏斗使用前应当用蒸馏水检验是否漏液 | |
| D. | 振荡、静置分层后,依次用两个不同的烧杯从下口分别接取上下两层液体 |
| A. | 新制氯水可使紫色石蕊试液先变红后褪色 | |
| B. | 实验室制取氯气时,常用饱和石灰水来吸收多余的氯气 | |
| C. | 漂白粉在漂白时产生次氯酸,所以漂白粉能使燃料等有机色素褪色 | |
| D. | 钾元素颜色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧置无色,然后再用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察 |
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 非标准状况下,1mol任何气体不可能占有22.4L体积 | |
| C. | 0.4.molH2、0.2molO2、和0.4molCO2组成的混合气体,在标准状况下约为22.4L | |
| D. | 同温、同压下,相同质量的CO和CO2具有相同的体积 |
| A. | 能使溴的四氯化碳溶液褪色 | B. | 是天然气的主要成分 | ||
| C. | 不能发生燃烧反应 | D. | 能发生加成反应 |
 .
. 