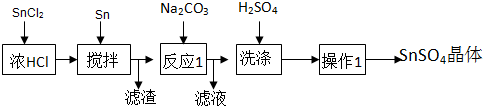
题目内容
14.已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | 该反应的平衡常数表达式为:K=[c(CH3OCH3)×c(H2O)]/c(CH3OH) | |
| B. | 此时正、逆反应速率的大小:v正<v逆 | |
| C. | 若加入CH3OH后,经10 min达到平衡,此时c(CH3OH)=0.04 mol/L | |
| D. | 10 min达到平衡时,反应速率v(CH3OH)=1.6 mol/(L•min) |
分析 A.平衡常数指:一定温度下,可逆反应到达平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积的比;
B.计算浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
C.由表中数据可知,甲醇的起始浓度为0.44mol/L+2×0.6mol/L=1.64mol/L,令平衡后c(CH3OCH3)=xmol/L,根据方程式可知平衡时c(CH3OH)=(1.64-2x)mol/L,c(H2O)=xmol/L,代入平衡常数k=$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$计算;
D.根据v=$\frac{△c}{△t}$计算v(CH3OH).
解答 解:A.2CH3OH(g)?CH3OCH3(g)+H2O(g)的平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,故A错误;
B.浓度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.34<K=400,反应向正反应进行,此时正、逆反应速率的大小:v正>v逆,故B错误;
C.由表中数据可知,甲醇的起始浓度为0.44mol/L+2×0.6mol/L=1.64mol/L,令平衡后c(CH3OCH3)=xmol/L,根据方程式可知平衡时c(CH3OH)=(1.64-2x)mol/L,c(H2O)=xmol/L,则$\frac{x×x}{(1.64-2x)^{2}}$=400,解得x=0.8,经10 min达到平衡,此时c(CH3OH)=0.04mol/L,故C正确;
D.10 min达到平衡时,反应速率v(CH3OH)=$\frac{1.6mol/L}{10min}$=0.16 mol/(L•min),故D错误,
故选:C.
点评 本题考查化学平衡计算、平衡常数应用,难度中等,根据化学平衡常数进行计算、判断反应进行方向是高考中经常涉及的内容.

| A. | 从1L2mol•L-1的NH4Cl溶液中,取出其中的500ml,则其物质的量浓度为1mol•L-1 | |
| B. | 1mol•L-1的NaCl溶液意义就是每升NaCl溶液中含有1molNaCl | |
| C. | 将4gNaOH溶解在100ml水中,所形成的溶液的物质的量浓度1mol•L-1 | |
| D. | 把50m2mol•L-1的CaCl2溶液加水稀释成100ml,则稀释后的溶液中所含的CaCl2的物质的量变成原来的一半 |
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( ) | 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10 min内甲容器中反应的平均速率v(A)=0.1 mol/(L•min) | |
| B. | T1<T2,正反应为吸热反应 | |
| C. | 平衡时保持温度不变,缩小容器体积平衡向正反应方向移动 | |
| D. | T1℃时,若起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为75% |
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | V正、V逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ? |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ? | V正=V逆 |
(3)己知:C (s)+$\frac{1}{2}$O2(g)═CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)═H2O (g);△H=-241.8kJ•mo1-1
那么,将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程△H=-78.7kJ•mo1-1.
| A. | 溶液、胶体、浊液 | B. | 浊液、胶体、溶液 | C. | 胶体、浊液、溶液 | D. | 浊液、溶液、胶体 |
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 非标准状况下,1mol任何气体不可能占有22.4L体积 | |
| C. | 0.4.molH2、0.2molO2、和0.4molCO2组成的混合气体,在标准状况下约为22.4L | |
| D. | 同温、同压下,相同质量的CO和CO2具有相同的体积 |
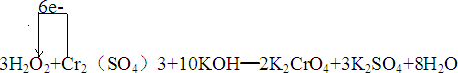 .
.