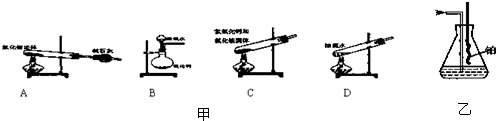
题目内容
13.如表是元素周期表的一部分,根据所给的10 种元素,回答下列问题.| 周期 族 | I | II | III | IV | V | VI | VII | O |
| 二 | C | F | ||||||
| 三 | Na | Mg | Al | Si | S | Cl | Ar |
(2)表中所列第三周期的元素中,原子半径最小的是Cl,这些元素形成的简单离子中,离子半径最小的是Al3+(填离子符号);
(3)元素最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式),能证明Al(OH)3具有两性的实验是b(或bc、cd、bd)(填序号);
a.向AlCl3溶液中加入过量氨水
b.将铝条放入NaOH溶液中
c.向Al(OH)3浊液中滴入过量盐酸
d.向NaOH溶液中滴入少量AlCl3溶液
(4)举出能证明非金属性Cl>S的实验事实(举一例即可)氯气通入氢硫酸溶液中置换出硫.
分析 (1)同周期从左到右,金属性减弱,同主族从上到下,非金属性减弱;非金属性越强,气态氢化物越稳定;处于金属与非金属界线处的元素可用于制造半导体材料;
(2)同周期随原子序数增大原子半径减小,电子层结构相同核电荷数越大,离子半径越小,电子层越多离子半径越大;
(3)非金属性越强,其最高价氧化物对应的水化物酸性越强(不是F,因为F无最高正价),则非金属性最强的为Cl,对应酸为高氯酸;氢氧化铝既能够与强酸反应,也能够与强碱溶液反应,证明氢氧化铝为两性氢氧化物,据此进行解答;
(4)氯气能够与硫化氢溶液反应生成硫单质,证明了非金属性Cl>S.
解答 解:(1)同周期,从左到右,金属性减弱,同主族,从上到下,非金属性减弱,故金属性最强的为钠,非金属性最强的元素是氟元素;
非金属性越强,气态氢化物越稳定,F元素的非金属性最强,故氟化氢最稳定;
Si元素位于金属与非金属的分界线处,可用于制造半导体材料,
故答案为:Na;HF;Si;
(2)同周期随原子序数增大原子半径减小,故第三周期中Cl原子半径最小;
电子层结构相同核电荷数越大,离子半径越小,电子层越多离子半径越大,故Al3+离子半径最小,
故答案为:Cl;Al3+;
(3)根据铜同周期从左向右最高价氧化物对应水化物的酸性越来越强,同主族从上向下最高价氧化物对应水化物的酸性越来越弱,则在前三个周期中,最高价氧化物对应水化物的酸性最强的元素是Cl(不是F,因为F无最高正价),其最高价氧化物对应水化物中酸性最强的是HClO4;
a.向AlCl3溶液中加入过量氨水,由于氨水为弱碱,无法证明氢氧化铝为两性氢氧化物;
b.将铝条放入NaOH溶液中,反应实质为铝与水反应生成氢氧化铝和氢气,氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,证明了氢氧化铝为两性氢氧化物,故b正确;
c.向Al(OH)3浊液中滴入过量盐酸,证明了氢氧化铝为碱性氢氧化物;
d.向NaOH溶液中滴入少量AlCl3溶液,证明了氢氧化铝为酸性氢氧化物;
根据以上分析可知,能够证明氢氧化铝为两性的为b(或bc、cd、bd),
故答案为:HClO4;b(或bc、cd、bd)
(4)氢硫酸溶液中通入氯气,二者反应生成S单质,证明了非金属性Cl>S,故答案为:氯气通入氢硫酸溶液中置换出硫.
点评 本题考查元素周期表和元素周期律的综合应用,题目难度中等,注意熟练掌握元素周期表结构、元素周期律内容,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 水晶和干冰的熔化 | B. | 食盐和冰醋酸熔化 | ||
| C. | 液溴和液汞的气化 | D. | 纯碱和烧碱的熔化 |
| A. | c(Z)=0.45mol/L | B. | c(Y2)=0.5mol/L | C. | c(X2)=0 | D. | c(X2)=0.5mol/L |
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 碱性:KOH>NaOH>LiOH | ||
| C. | 单质的氧化性:F2<Cl2<Br2<I2 | D. | 单质的还原性:Al<Mg<Na |
| A. | 漂粉精 | B. | 冰醋酸 | C. | 汽油 | D. | 铝热剂 |
| A. | 混合气体的密度不再改变 | |
| B. | 混合气体的平均分子量不再改变 | |
| C. | 混合气体中,N2、H2、NH3的物质的量之比为1:3:2 | |
| D. | 1个N≡N键断裂的同时,有6个N-H键形成 |
| A. | N2的结构式:N-N | B. | Mg2+的结构示意图: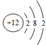 | ||
| C. | -CH3(甲基)的电子式: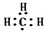 | D. | CO2分子的比例模型: |
| A. | AlCl3 | B. | Al(OH)3 | C. | KOH | D. | HCl |
 NH3•H2ONH3•H2O
NH3•H2ONH3•H2O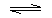 NH4++OH-
NH4++OH-