题目内容
5.在实验室有几种方法可制取氨气:(1)通常用加热消石灰与氯化铵固体的方法来制取氨气.
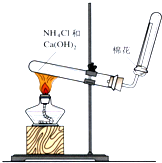
①写出此反应的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,图甲是实验室制取氨气的装置和选用的试剂,其中错误的是AC
②氨气可使湿润的红色的石蕊试纸变蓝的原因(用方程式表示)NH3+H2O
 NH3•H2ONH3•H2O
NH3•H2ONH3•H2O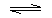 NH4++OH-
NH4++OH-③用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,锥形瓶中不可能生成的物质是:A
A.H2 B.NO2 C.HNO3 D.NH4NO3
(2)如果在实验室里检验某白色固体是铵盐,提供下列试剂给你选择,其中最不可能会被用到的试剂是D
A.蒸馏水 B.氢氧化钠溶液 C.浓盐酸 D.稀硫酸
(3)已知:3Cl2+2NH3→N2+6HCl,常温常压下,在一密闭容器中将15ml Cl2和40ml NH3充分反应后,剩余气体的体积为5mL.
分析 (1)①氢氧化钙与氯化铵加热条件下生成氨气、氯化钙和水;制备氨气的简易方法:加热浓氨水,将浓氨水逐滴加入碱石灰(生石灰),结合装置图解答;
②氨气溶液水与水反应生成一水合氨,一水合氨电离生成氨根离子和氢氧根离子,溶液显碱性,遇到红色石蕊试纸变蓝;
③氨气与氧气在铂做催化剂条件下发生催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,硝酸与氨气反应生成硝酸铵,据此解答;
(2)实验室里检验某白色固体是铵盐,可以将固体溶于水,然后加入氢氧化钠溶液放热,再利用浓盐酸检验是否有氨气生成;
(3)根据反应判断3Cl2+2NH3→N2+6HCl判断氨气过量,计算出生成的氯化氢的体积,再根据氯化氢与氨气生成氯化铵,计算出二者恰好反应,最后剩余的气体是氮气.
解答 解:(1)①加热消石灰与氯化铵固体反应生成氯化钙、氨气和水,方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
图甲中:A.氯化铵受热分解生成的氨气与氯化氢,在试管口又重新反应生成氯化铵,不能制取氨气,故A选;
B.浓氨水具有挥发性,滴入到生石灰,水与氧化钙反应放出的热量促使氨气挥发,可以制备氨气,故B不选;
C.试管口应向下倾斜,装置错误,故C选;
D.浓氨水易挥发,加热浓氨水,促进氨气逸出,能制取氨气,故D不选;
故选:AC;
②氨气可使湿润的红色的石蕊试纸变蓝的原因,氨气氨气溶液水与水反应生成一水合氨,化学方程式:NH3+H2O 
故答案为:NH3+H2O 
③氨气与氧气在铂做催化剂条件下发生催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,硝酸与氨气反应生成硝酸铵,该过程中没有涉及到的物质为氢气,
故选:A;
(2)实验室里检验某白色固体是铵盐,可以将固体溶于水,然后加入氢氧化钠溶液放热,再利用浓盐酸检验是否有氨气生成,若产生大量白烟则含有氨气,用到的药品有:蒸馏水、氢氧化钠、浓盐酸,用不到的是稀硫酸;
故选:D;
(3)15ml Cl2和40ml NH3反应,根据反应方程式3Cl2+2NH3=N2+6HCl,15mL氯气反应消耗氨气10mL氨气,生成5mL氮气和30mL氯化氢;由于氨气与氯化氢反应生成氯化铵,剩余的氨气恰好与生成的氯化铵反应,剩余最后剩余的气体是氮气,体积为5mL,
故答案为:5.
点评 本题考查了氨气的制备和性质的检验,熟练掌握氨气制备原理和装置特点及氨气的化学性质是解题关键,题目难度中等.

| A. | v=0.10 mol•L-1•s-1是指1 s内某物质的物质的量浓度为0.10 mol•L-1 | |
| B. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 | |
| C. | 化学反应速率只是对可逆反应才适用 | |
| D. | 根据反应速率的大小,可以知道反应进行的相对快慢 |
| A. | 质子数:c>d | B. | 离子的还原性:Y2->Z- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 原子半径:X<W |
| 周期 族 | I | II | III | IV | V | VI | VII | O |
| 二 | C | F | ||||||
| 三 | Na | Mg | Al | Si | S | Cl | Ar |
(2)表中所列第三周期的元素中,原子半径最小的是Cl,这些元素形成的简单离子中,离子半径最小的是Al3+(填离子符号);
(3)元素最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式),能证明Al(OH)3具有两性的实验是b(或bc、cd、bd)(填序号);
a.向AlCl3溶液中加入过量氨水
b.将铝条放入NaOH溶液中
c.向Al(OH)3浊液中滴入过量盐酸
d.向NaOH溶液中滴入少量AlCl3溶液
(4)举出能证明非金属性Cl>S的实验事实(举一例即可)氯气通入氢硫酸溶液中置换出硫.
| A. | 乙醇的结构简式C2H6O | B. | 溴乙烷的分子式C2H5Br | ||
| C. | 羟基的电子式:${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H | D. | 化学名词:苯、油酯、坩锅 |
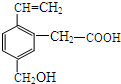 某有机物的结构如图所示,这种有机物可能具有的性质是( )
某有机物的结构如图所示,这种有机物可能具有的性质是( )①能发生氧化反应;②能使溴水褪色;③能跟NaOH溶液反应;④能发生酯化反应;
⑤能发生加成反应;⑥能发生银镜反应.
| A. | 只有②④ | B. | 只有②③④ | C. | 只有①②③④⑤ | D. | 全部 |




 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$
 ,④的反应类型取代反应(或水解反应).
,④的反应类型取代反应(或水解反应). .
.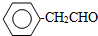 或
或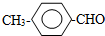 .
. (1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)