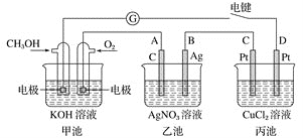
题目内容
【题目】关于下列图示的说法中,正确的是:
① ② ③ ④
A.图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.用图③所示实验装置制备BaSO3沉淀
D.图④装置可以用来除去SO2中的HCl
【答案】A
【解析】
A.硫酸与碳酸钠反应生成二氧化碳,二氧化碳通入到硅酸钠溶液中产生硅酸沉淀,因此图①所示实验可比较硫、碳、硅三种元素的非金属性强弱,A正确。
B.CO2的密度大于空气的,所以②中应该是长口进短口出,B不正确。
C.SO2溶于水显酸性,在酸性条件下,硝酸钡能把SO2氧化生成硫酸,进而生成硫酸钡沉淀,C不正确。
D.氢氧化钠溶液也能吸收SO2,应该用饱和亚硫酸氢钠溶液,D不正确;
答案选A。

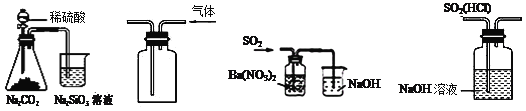
【题目】下列实验设计能够成功的是 ( )
实验目的 | 实验步骤及现象 | |
A | 检验亚硫酸钠试样是否变质 | 试样 |
B | 检验某盐是否为铵盐 | 试样 |
C | 证明酸性条件下H2O2氧化性比I2强 | NaI溶液 |
D | 除去氯化钠晶体中少量硝酸钾 | 试样 |
A.AB.BC.CD.D
【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
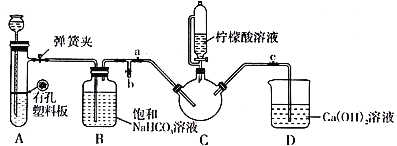
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(写化学式)。再滴加少量稀硫酸的作用是__________________________。
(2)实验II中:生成沉淀的离子方程式为__________________________。
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为___________________。
②装置A中所盛放的药品是___________________。(填序号)
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是____________________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是________________。
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为________%。