题目内容
【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
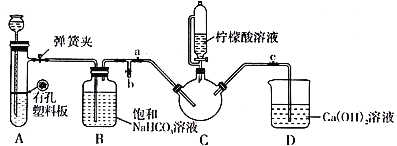
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(写化学式)。再滴加少量稀硫酸的作用是__________________________。
(2)实验II中:生成沉淀的离子方程式为__________________________。
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为___________________。
②装置A中所盛放的药品是___________________。(填序号)
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是____________________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是________________。
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为________%。
【答案】 Fe 防止Fe2+水解 Fe2++2HCO3-=FeCO3↓+CO2↑+ H2O 滴液漏斗 C D中澄清石灰水变浑浊 防止二价铁被氧化 B 85
【解析】考查实验方案设计与评价,(1)Fe2+具有还原性,能被空气中氧气氧化,因此需要加入Fe粉,防止Fe2+被氧化;Fe2+能发生水解,加入稀硫酸的目的是抑制Fe2+的水解;(2)实验II制备的是FeCO3,所用试剂为FeSO4和NH4HCO3,利用HCO3-的电离HCO3-![]() CO32-+H+,Fe2+结合CO32-,促使平衡向正反应方向进行,H+浓度增大,H+与HCO3-反应生成CO2,因此离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;(3)①根据仪器的特点,盛放柠檬酸打的仪器是滴液漏斗;②装置A制备CO2,装置A为启普发生器的简易装置,因此盛放的药品是CaCO3和盐酸,故C正确;③空气排尽,CO2充满装置,即装置D中出现白色沉淀,或溶液变浑浊;④根据信息,柠檬酸具有还原性和强酸性,能够促进FeCO3的溶解,防止Fe2+被氧化;⑤甘氨酸亚铁易溶于水,难溶于乙醇,因此用乙醇溶液洗涤,故选项B正确;⑥根据元素守恒,FeCO3过量,甘氨酸不足,因此甘氨酸亚铁的物质的量为0.2/2mol=0.1mol,质量为20.4g,产率为17.34/20.4×100%=85%。
CO32-+H+,Fe2+结合CO32-,促使平衡向正反应方向进行,H+浓度增大,H+与HCO3-反应生成CO2,因此离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;(3)①根据仪器的特点,盛放柠檬酸打的仪器是滴液漏斗;②装置A制备CO2,装置A为启普发生器的简易装置,因此盛放的药品是CaCO3和盐酸,故C正确;③空气排尽,CO2充满装置,即装置D中出现白色沉淀,或溶液变浑浊;④根据信息,柠檬酸具有还原性和强酸性,能够促进FeCO3的溶解,防止Fe2+被氧化;⑤甘氨酸亚铁易溶于水,难溶于乙醇,因此用乙醇溶液洗涤,故选项B正确;⑥根据元素守恒,FeCO3过量,甘氨酸不足,因此甘氨酸亚铁的物质的量为0.2/2mol=0.1mol,质量为20.4g,产率为17.34/20.4×100%=85%。

【题目】下列按电解质、非电解质、酸性氧化物、碱性氧化物的组合,正确的是( )
选项 | 电解质 | 非电解质 | 酸性氧化物 | 碱性氧化物 |
A | HCl | 液氨 | CO | K2O |
B | 氯化钠溶液 | 蔗糖 | SiO2 | CaO |
C | 熔融NaCl | 氨水 | SO2 | Al2O3 |
D | CaSO4 | 酒精 | CO2 | Na2O |
A.AB.BC.CD.D




