��Ŀ����
����Ŀ����ͼװ��(�����Ժ�)�о����������ķ�Ӧ��

ʵ�鲽�裺
����һ����Ũ�������KMnO4��ĩ�ϣ�������������ɫ���塣
��������ɫ������ȳ�������ƿʱ���ر�ֹˮ�С�
�����������ϵ�2��ˮ��Ƭ�̺���ȼ�գ��������̣���ɫ���帽���ڼ���ƿ�ڱ��ϡ�
(1)������������ɫ��������������KMnO4��������__________(������������������ԭ����)��
(2)��������������ȼ�յ�ԭ����____________��
(3)���ɰ�ɫ����Ļ�ѧ����ʽ��______________��
(4)������ӷ���ʽ˵��NaOH��Һ��������_______________��
(5)ʵ�������ͬѧ�ڰ�ȫ������������ָ���£�������ͼװ�þ�����˼���ƿ�ڲ��������Ĵ������������____________��
���𰸡������� Na��ˮ��Ӧ���ȣ��ﵽNa��Cl2��ȼ�յ��Ż�� 2Na��Cl2![]() 2NaCl Cl2��2OH����Cl����ClO����H2O��������������ֹ����Ⱦ���� ��ֹˮ��
2NaCl Cl2��2OH����Cl����ClO����H2O��������������ֹ����Ⱦ���� ��ֹˮ��
��������
��1�����ݷ�Ӧ��Ԫ�صĻ��ϼ۱仯�������������ص����ã�
��2���ƺ�ˮ�ķ�Ӧ�Ƿ��ȷ�Ӧ���ݴ��жϣ�
��3������������ȼ�������Ȼ��ƣ�
��4�������ж�����ֱ���ſգ�������ˮ��Ӧ�����ᣬ���ܺͼ���кͷ�Ӧ��
��5�������ж�����ֱ���ſգ������ü�Һ���ա�
��1���÷�Ӧ�в����Ļ���ɫ��������������HCl����Ԫ��ʧȥ����ת��Ϊ������ClԪ�ػ��ϼ���-1�۱�Ϊ0�ۣ���HCl�ǻ�ԭ����������Ը�������������������������ԣ�
��2��������������ȼ�գ�Na��ˮ��Ӧ���ȣ��ﵽNa��Cl2��ȼ�յ��Ż�㣬�Ӷ������Ƶ�ȼ�գ�
��3������������ȼ�������Ȼ��ƣ����ɫ������NaCl����Ӧ�Ļ�ѧ����ʽΪ2Na��Cl2![]() 2NaCl��
2NaCl��
��4�������ж�����ֱ���ſգ�������ˮ��Ӧ�����ᣬ���ܺͼ���кͷ�Ӧ������NaOH��Һ������������������ֹ����Ⱦ��������Ӧ�ķ���ʽΪCl2��2OH����Cl����ClO����H2O��
��5�������ж�����ֱ���ſգ������ü�Һ���գ�������Ǵ�ֹˮ�У�������ѹ����Һѹ�뼴��������������ֹ������Ⱦ��

 ÿ�α���ϵ�д�
ÿ�α���ϵ�д�����Ŀ���±����и���������������֮����ͨ��һ����Ӧʵ����ͼ��ʾת������
���� ѡ�� | �� | �� | �� |
A | SO2 | SO3 | H2SO4 |
B | NH4Cl | NH3 | NO |
C | Na2O | NaCl | NaOH |
D | Al(OH)3 | Al2O3 | AlCl3 |
A. A B. B C. C D. D
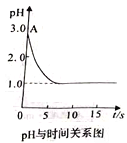
����Ŀ��25��ʱ�����ʵ���Ũ�Ⱦ�Ϊ0.1molL��1�ļ�������Һ��pH�����
��� | �� | �� | �� | �� | �� |
��Һ | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
��1��������ˮ�������c(OH��)________(����>������������<��)������ˮ�������c(H��)��
��2�����й�����______�����ӣ�pH=8.4��ԭ��_______________________________��
��3������˵����ȷ����_____��
A��c(NH4+)��������
B�����ʵ���Ũ�Ⱥ��������ȵ�NaCl��CH3COONH4������Һ�У������������
C����������������γɵĻ����Һ�У�c(HCO3��)+c(CO32��)=0.1molL��1
D����pH��ͬ��CH3COOH��HX��Һ��ˮϡ����ͬ������HX��Һ��pH�仯С
��4����������20 mL 0.1 mol��L��1 Na2CO3��Һ����μ���0.1 mol��L��1 HCl��Һ40 mL����Һ�к�̼Ԫ�صĸ�����(CO2���ݳ�δ����)���ʵ�������(����)����ҺpH�仯�IJ��������ͼ��ʾ��
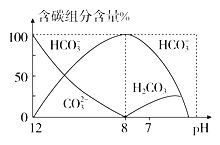
�ش��������⣺
����pH��7ʱ����Һ�к�̼Ԫ�ص���Ҫ��Ϊ________
����֪��25 ��ʱ��CO![]() ˮ�ⷴӦ��ƽ�ⳣ��Kh��
ˮ�ⷴӦ��ƽ�ⳣ��Kh��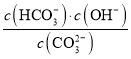 ��2.0��10-4 mol��L-1������Һ��c(HCO
��2.0��10-4 mol��L-1������Һ��c(HCO![]() )��c(CO
)��c(CO![]() )��2��1ʱ����Һ��pH��______________��
)��2��1ʱ����Һ��pH��______________��
����Ŀ������������һ�ֳ���ʳƷ���Ӽ���Ϊ���ijʳƷ���������κ���(ͨ����1 kg��Ʒ�к�SO2��������)��ij�о�С���������������ʵ�����̣�
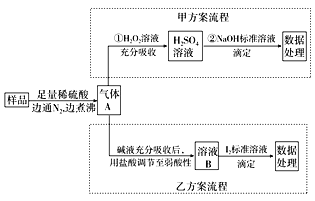
��1������������������H2O2��______�ԣ�H2O2�Ƕ�Ԫ���ᣬд��H2O2���뷽��ʽ________________________
��2������������ѡ��̪��ָʾ�����еζ���Ӧѡ��ͼ��________�ζ���(����)���ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲�________��

A���ζ�����Һ��ı仯
B����ƿ����Һ��ɫ�ı仯
�ζ��յ���Һ��ɫ�ı仯��__________________________________________
��3��д���ҷ����ζ�ʱ�����ӷ���ʽ��___________________________________��
��4�����ҷ�����ȡ��Ʒ20g���100mL��Һ���ζ�����0.01000 mol��L��1 I2��Һ����������ʾ��
�ζ����� | ������Һ ���/mL | ����Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 20.00 | 1.02 | 21.03 |
2 | 20.00 | 2.00 | 25.00 |
3 | 20.00 | 0.60 | 20.59 |
�ζ������ϴ���ǵ�________��ʵ�飬����������Ŀ���ԭ����________��
A���ζ�����װҺǰδ�ñ���Һ��ϴ2��3��
B���ζ���ʼǰ�ζ��ܼ��첿�������ݣ��ڵζ��յ����ʱδ��������
C���ζ���ʼǰ�ζ��ܼ��첿��û�����ݣ��ڵζ��յ����ʱ���ּ��첿��������
D���ﵽ�ζ��յ�ʱ��������Һ��Һ����͵����
E���ζ������У���ƿҡ����̫���ң�������ЩҺ�ηɽ�����
��1 kg��Ʒ�к�SO2��������________g��