题目内容
【题目】含铁化合物在生活生产中应用广泛。如高铁酸盐(FeO42-)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO与Fe(NO3)3饱和溶液反应可制备K2FeO4,两种溶液的混合方式为____。
A.在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中
B.在搅拌下,将KClO饱和溶液缓慢滴加到Fe(NO3)3饱和溶液中
C.在搅拌下,将KClO饱和溶液和Fe(NO3)3饱和溶液一起加入
反应的离子方程式为______________________________。
(2)高铁酸盐有极强的氧化性,能迅速有效地去除淤泥中的臭味物质,自身被还原成新生态的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其浓度小于10-5 mol·L-1),需调节溶液的pH>____。
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用0.100 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式(写出计算过程)______________________。
【答案】A 3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O 3 Fe4(OH)2(SO4)5
【解析】
(1)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中;
(2)当Fe3+完全沉淀时,c(Fe3+)<10-5mol/L,则该溶液中c(OH-)=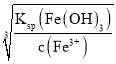 ,然后根据水的离子积常数计算溶液中c(H+);
,然后根据水的离子积常数计算溶液中c(H+);
(3)根据S元素守恒,可由BaSO4沉淀的质量计算20.00 mL溶液中:n(SO42-)=n(BaSO4),再根据:5Fe3+~5Fe2+~MnO4-,计算n(Fe3+);由电荷守恒:3n(Fe3+)=2n(SO42-)+n(OH-)计算n(OH-),进而计算n(Fe3+):n(OH-):n(SO42-),可确定化学式。
(1)制备K2FeO4时,KClO饱和溶液与Fe(NO3)3溶液的混合方式为:将Fe(NO3)3溶液慢慢滴入KClO溶液中,根据电荷守恒、电子守恒、原子守恒,可得该反应的离子方程式是3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(2)当Fe3+完全沉淀时,c(Fe3+)<1.0×10-5mol/L,则该溶液中c(OH-)=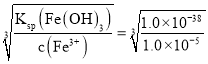 =1.0×10-11mol/L,则根据室温下水的离子积常数Kw=1.0×10-14mol2/L2可知溶液中 c(H+)=
=1.0×10-11mol/L,则根据室温下水的离子积常数Kw=1.0×10-14mol2/L2可知溶液中 c(H+)=![]() mol/L=1.0×10-3mol/L,所以溶液的pH=3;
mol/L=1.0×10-3mol/L,所以溶液的pH=3;
(3)20.00 mL溶液中:n(SO42-)=n(BaSO4)=![]() =0.0500 mol,根据电子守恒可得关系式:5Fe3+~5Fe2+~MnO4-,n(Fe3+)=5n(MnO4-)=5×0.100 0 mol/L×8.00×10-3 L×
=0.0500 mol,根据电子守恒可得关系式:5Fe3+~5Fe2+~MnO4-,n(Fe3+)=5n(MnO4-)=5×0.100 0 mol/L×8.00×10-3 L×![]() =0.0400 mol,由电荷守恒:3n(Fe3+)=2n(SO42-)+n(OH-),n(OH-)=3n(Fe3+)-2n(SO42-)=3×0.0400mol-2×0.0500mol=0.0200mol,所以n(Fe3+):n(OH-):n(SO42-)=0.0400mol:0.0200mol:0.0500mol=4:2:5,所以该聚合硫酸铁的化学式为Fe4(OH)2(SO4)5。
=0.0400 mol,由电荷守恒:3n(Fe3+)=2n(SO42-)+n(OH-),n(OH-)=3n(Fe3+)-2n(SO42-)=3×0.0400mol-2×0.0500mol=0.0200mol,所以n(Fe3+):n(OH-):n(SO42-)=0.0400mol:0.0200mol:0.0500mol=4:2:5,所以该聚合硫酸铁的化学式为Fe4(OH)2(SO4)5。