题目内容
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | ||
| B、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | ||
C、CH3COOH溶液加水稀释后,溶液中
| ||
| D、Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
考点:反应热和焓变,原电池和电解池的工作原理,弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论
分析:A、当△G=△H-T?△S<0时,反应能自发进行;
B、用电解法精炼精铜时,粗铜作阳极,纯铜作阴极;
C、加水稀释促进电离平衡正向进行;
D、Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,加入少量Ca(OH)2固体,Ca2+、CO32-反应生成碳酸钙沉淀,平衡逆向移动,氢氧根离子浓度增大.
B、用电解法精炼精铜时,粗铜作阳极,纯铜作阴极;
C、加水稀释促进电离平衡正向进行;
D、Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,加入少量Ca(OH)2固体,Ca2+、CO32-反应生成碳酸钙沉淀,平衡逆向移动,氢氧根离子浓度增大.
解答:
解:A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,△G=△H-T?△S<0,△S<0,所以该反应的△H<0,故A错误;
B、电解法精炼铜时,以粗铜作阳极,纯铜作阴极,故B错误;
C、CH3COOH?CH3COO-+H+;加水稀释促进电离平衡正向进行,n(CH3COOH)减小,n(CH3COO-)增大,
=
减小,故C正确;
D、D、Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,加入少量Ca(OH)2固体,Ca2+、CO32-反应生成碳酸钙沉淀,平衡逆向移动,水解程度减小,氢氧根离子浓度增大,溶液的pH增大,故D错误;
故选C.
B、电解法精炼铜时,以粗铜作阳极,纯铜作阴极,故B错误;
C、CH3COOH?CH3COO-+H+;加水稀释促进电离平衡正向进行,n(CH3COOH)减小,n(CH3COO-)增大,
| C(CH3COOH) |
| C(CH3COO-) |
| n(CH3COOH) |
| n(CH3COO-) |
D、D、Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,加入少量Ca(OH)2固体,Ca2+、CO32-反应生成碳酸钙沉淀,平衡逆向移动,水解程度减小,氢氧根离子浓度增大,溶液的pH增大,故D错误;
故选C.
点评:本题主要考查了反应的自发性、电解原理、平衡原理的运用,难度不大,掌握原理即可解答.

练习册系列答案
相关题目
某二元弱酸H2A,在溶液中可以发生一级和二级电离:H2A?H++HA-,HA-?H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列溶液中H2A浓度最大的是( )
| A、0.01mol/L的H2A溶液 |
| B、0.01mol/L的NaHA溶液 |
| C、0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合 |
| D、0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合 |
设NA代表阿伏加德罗常数,以下说法不正确的是( )
| A、18g水中含有电子数为10NA |
| B、16g氧气所含原子数为NA |
| C、4.8g金属镁变成镁离子时失去电子数为0.2NA |
| D、46g二氧化氮和46g四氧化二氮含有的原子数均是3NA |
正确的实验设计和操作是实验成功的重要因素,下列实验设计或操作正确的是( )
A、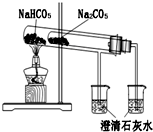 证明热稳定性Na2CO3>NaHCO3 |
B、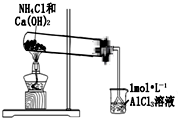 证明氢氧化铝的两性 |
C、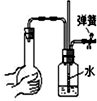 检查装置气密性 |
D、 测定KClO3元素的质量 |
设NA为阿伏加德罗常数的值,下列说法正确的组合是( )
| A、常温下,1mol/L的NH4NO3溶液中含有氮原子的数目为2NA |
| B、17g H2O2中含有的电子数为9NA |
| C、将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA |
| D、常温下,100mL 1mol?L-1 AlCl3溶液中铝离子数为0.1NA |
下列离子反应方程式正确的是( )
| A、AlCl3溶液滴入到足量的氨水中:A13++4NH3?H2O═A1O2-+4NH4++2H2O |
| B、碳酸氢钙溶液中加入少量苛性钾溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| C、钠与水反应:Na+H2O═Na++OH-+H2↑ |
| D、过量二氧化碳通入氢氧化钠溶液中 CO2+OH-═HCO3- |
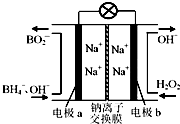 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A、电池放电时Na+从a极区移向b极区 |
| B、每消耗3mol H2O2,转移的电子为3mol |
| C、电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| D、该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
下列说法不正确的是( )
| A、在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023 |
| B、一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8×6.02×1023 |
| C、含有非极性键的数目为6.02×1023的Na2O2与水充分反应,标况下产生O2 22.4L |
| D、100mL 1mol/L AlCl3与3mol/L NaCl的混合溶液中,Cl-的个数为0.6×6.02×1023 |
下列各组离子中,一定能大量共存的是( )
| A、无色溶液中:Cu2+、Ca2+、Cl-、SO42- |
| B、强碱性溶液中:K+、Al3+、HCO3-、SO42- |
| C、pH=1的溶液中:Na+、Fe2+、NO3-、S2- |
| D、Ba2+、OH-、Cl-、K+ |