题目内容
2.原子核外电子排布式为[Ar]3d54s2的元素是( )| A. | Cr | B. | ds 区元素 | C. | ⅡA族元素 | D. | ⅦB族元素 |
分析 基态原子的核外电子排布为[Ar]3d54s2,可知有4个电子层,最外层电子数为2,最后填充的电子为d电子,价电子排布为3d54s2,据此判断该元素在周期表中的位置及名称.
解答 解:基态原子的核外电子排布为[Ar]3d54s2,最后填充的电子为d电子,为d区元素,
该元素含有4个电子层、最外层电子数为2,价电子排布为3d54s2,该元素位于周期表中第四周期、ⅦB族,为Mn元素,
根据分析可知,ABC错误、D正确,
故选D.
点评 本题考查元素结构与位置的应用,为高频考点,题目难度中等,把握原子结构与元素位置的关系为解答的关键,侧重分析与应用能力的考查,注意掌握最后填充电子及价电子的判断方法.

练习册系列答案
相关题目
12.下列各组物质的晶体中化学键类型相同,晶体类型也相同的是( )
| A. | CO2和H2O | B. | NaCl和HCl | C. | SO2和SiO2 | D. | NaOH和CCl4 |
10.下列说法不正确的是( )
| A. | 对稀土元素及化合物的研究是获得优良催化剂的一种重要途径 | |
| B. | 油脂是人体中热值最高的营养物质,在工业上可用于制肥皂和油漆 | |
| C. | 离子键、共价键和氢键等化学键都可能对物质的熔沸点产生影响 | |
| D. | 高分子膜在分离提纯、物质制备以及能量转化等领域都有广泛应用 |
7.有关氨气和甲烷分子空间构型叙述正确的是( )
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 | |
| B. | NH3为三角锥形,甲烷是正四面体形 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较弱 | |
| D. | NH3和CH4都是sp3型杂化,键角都是109°28′ |
11.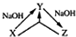 化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
 化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )| A. | AlCl3 | B. | CO2 | C. | SiO2 | D. | H2S |
12.下列化合物中,含有非极性共价键的离子化合物是( )
| A. | C2H4 | B. | CaCl2 | C. | Na2O2 | D. | NH4NO3 |
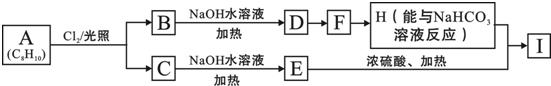
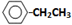 .
.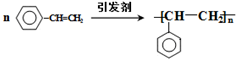 .
.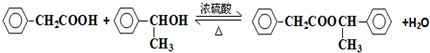 .
.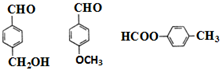 (其中两种).
(其中两种).

 ,它的分子中含有4种不同化学环境的氢原子.
,它的分子中含有4种不同化学环境的氢原子. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
.