题目内容
【题目】亚铁盐在空气中一般都易被氧化,而摩尔盐[(NH4)2SO4FeSO46H2O]比一般的亚铁盐要稳定,但受热时易分解易被氧化。其实验室的制备原理为:FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4FeSO46H2O↓
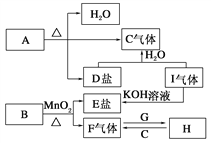
如图为制取摩尔盐的简要流程:

请回答下列问题:
(1)步骤①中反应容器应尽量避免摇晃或搅拌,目的是___。
(2)步骤②中的操作是加热蒸发、___、___。为什么不能加热蒸干___。
(3)摩尔盐中NH4+、Fe2+、SO42-的检验:
①甲同学提出可以用湿润的___试纸、稀盐酸和___溶液来检验这三种离子。
②乙同学提出检验其中的Fe2+,可以用KSCN溶液和___,预期的现象和结论是___。
③实际操作中,乙同学加人KSCN溶液时,发现溶液变成浅红色,于是他对自己的方法提出了怀疑。丙同学经过仔细思考认为,乙同学的方法是可行的,这是因为___。
(4)丁同学欲测定摩尔盐中Fe2+的含量。他称取了4.0g摩尔盐样品,溶于水,并加入适量稀硫酸,用0.20mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL。
①本实验的指示剂是___(填字母)。
A.酚酞 B.石蕊 C.甲基橙 D.不需要
②KMnO4溶液置于______________ (填“酸式”或“碱式”)滴定管中
③滴定终点的现象是____________________________________________________。
④产品中Fe2+的百分含量是_________________________________。
【答案】防止Fe2+被氧化 冷却结晶 过滤 摩尔盐受热易分解易被氧化 红色石蕊 氢氧化钡 氯水(或双氧水) 加入KSCN溶液无明显现象,再加入氯水,溶液变红,则证明溶液中含有Fe2+ 继续加入氯水后,溶液红色显著加深,则证明溶液中含有Fe2+ D 酸式 滴入最后一滴KMnO4溶液摇匀后,锥形瓶中的溶液由浅绿色变为浅红色,且30 s内不褪色 14%
【解析】
⑴尽量避免摇晃或搅拌,防止Fe2+被氧化。
⑵还需要冷却结晶、过滤;摩尔盐受热易分解易被氧化。
⑶根据题意,铵根与氢氧反应生成氨气可使红色石蕊变蓝,氢氧根与亚铁离子反应,硫酸根用钡离子检验;②氯水(或双氧水)和KSCN溶液检验溶液中含有Fe2+;③利用平衡移动分析继续加入氯水后,溶液红色显著加深。
⑷①KMnO4溶液本身有色,不需要指示剂;②酸性、氧化性试剂应该选择酸式滴定管;③滴入最后一滴KMnO4溶液摇匀后,锥形瓶中的溶液由浅绿色变为浅红色,且30 s内不褪色;④根据电子守恒得出KMnO4 ~5 Fe2+,先求Fe2+的物质的量,再求Fe2+的百分含量。
⑴尽量避免摇晃或搅拌,防止Fe2+被氧化。
⑵还需要冷却结晶、过滤;摩尔盐受热易分解易被氧化。
⑶根据题意,铵根与氢氧反应生成氨气可使红色石蕊变蓝,氢氧根与亚铁离子反应,硫酸根先加氢氧化钡,再加盐酸,有白色沉淀;故答案为:红色石蕊;氢氧化钡。
②氯水(或双氧水),加入KSCN溶液无明显现象,再加入氯水,溶液变红,则证明溶液中含有Fe2+;故答案为:加入KSCN溶液无明显现象,再加入氯水,溶液变红,则证明溶液中含有Fe2+。
③继续加入氯水后,溶液红色显著加深,则证明溶液中含有Fe2+;故答案为:继续加入氯水后,溶液红色显著加深,则证明溶液中含有Fe2+。
⑷①KMnO4溶液本身有色,不需要指示剂;故答案为D。
②酸性、氧化性试剂应该选择酸式滴定管;故答案为酸式。
③滴入最后一滴KMnO4溶液摇匀后,锥形瓶中的溶液由浅绿色变为浅红色,且30 s内不褪色;故答案为:滴入最后一滴KMnO4溶液摇匀后,锥形瓶中的溶液由浅绿色变为浅红色,且30 s内不褪色。
④根据电子守恒KMnO4 ~5 Fe2+,所以![]() ,Fe2+的百分含量为
,Fe2+的百分含量为![]() ;故答案为14%。
;故答案为14%。

 口算题天天练系列答案
口算题天天练系列答案【题目】一定温度下,向 2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前 50 s 的平均速率v(PCl3)=0.0032 mol·L1·s1
B.该条件下,反应的平衡常数K=0.05
C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L1,则反应的ΔH<0
D.其他条件相同时,向空的容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,此时 v(正)>v(逆)