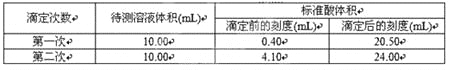
题目内容
【题目】四氯化锡常用作媒染剂、有机合成中的催化剂,已知SnCl4易水解,溶点为-33℃、沸电为114℃。某研究性学习小组设计如图装置(部分夹持装置及加热仪器省略)制备SnCl4。
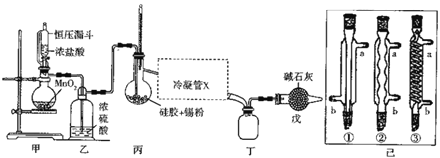
(1)装置甲中反应的离子方程式为___。整个制备装置中有一处不足,改进的方法是___。
(2)利用改进后的装置进行实验(下同)时甲、丙均需加热,首先加热的是___处的烧瓶,冷凝管x是已中的一种,该仪器的编号是___,装置戊的用途是___。
(3)实验过程中装置甲中除观察到固体溶解外,还可观察到的明显变化是___。
(4)该小组的甲同学提出,可利用标准NaOH溶液滴定甲中剩余溶液的方法测定出盐酸与MnO2反应的最低浓度。
①滴定时所用指示剂最好是___[假设开始出现Mn(OH)2,沉淀时的pH约为6.8]。
②假设实验时从甲中准确取出V2 mL剰余溶液并稀释到V3mL,然后用0.1000molL-1的 NaOH溶液进行滴定,滴定终点时消耗掉V1 mLNaOH溶液,则盐酸与MnO2反应时最低浓度应大于___。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 甲与乙之间连一个盛有饱和食盐水的洗气瓶 甲 ① 防止空气中水份进入丁装置,同时可以吸收氯气尾气 有黄绿色气体生成 甲基橙
Mn2++Cl2↑+2H2O 甲与乙之间连一个盛有饱和食盐水的洗气瓶 甲 ① 防止空气中水份进入丁装置,同时可以吸收氯气尾气 有黄绿色气体生成 甲基橙 ![]()
【解析】
根据实验装置图可知,甲装置用MnO2和浓盐酸在加热条件下制取氯气,发生的反应为MnO2 + 4H++2Cl-![]() Mn2+ + Cl2↑ + 2H2O,乙装置用浓硫酸干燥氯气,丙装置用锡与氯气反应生成SnCl4,为了便于生成的液态SnCl4顺利流下,应用直形冷凝管冷却,SnCl4易水解,为防止空气中水份进入丁与生成的SnCl4反应,丁后面连接一个戊装置,同时可以吸收氯气尾气,在制氯气的实验中,浓盐酸具有挥发性,加热促进挥发,所以生成的氯气中含有HCl,为防止Sn与HCl反应,在甲与乙之间还应再加一个除氯化氢的装置,即连一个盛有饱和食盐水的洗气瓶,利用标准NaOH溶液滴定甲中剩余溶液中的盐酸浓度,要防止锰离子出现沉淀,所以滴定终点的pH值要小于6.8,所以要用甲基橙做指示剂,根据氢氧化钠的物质的量可计算出V2mL剰余溶液中氯化氢的物质的量,进而可计算出此时溶液中氯化氢的物质的量浓度。
Mn2+ + Cl2↑ + 2H2O,乙装置用浓硫酸干燥氯气,丙装置用锡与氯气反应生成SnCl4,为了便于生成的液态SnCl4顺利流下,应用直形冷凝管冷却,SnCl4易水解,为防止空气中水份进入丁与生成的SnCl4反应,丁后面连接一个戊装置,同时可以吸收氯气尾气,在制氯气的实验中,浓盐酸具有挥发性,加热促进挥发,所以生成的氯气中含有HCl,为防止Sn与HCl反应,在甲与乙之间还应再加一个除氯化氢的装置,即连一个盛有饱和食盐水的洗气瓶,利用标准NaOH溶液滴定甲中剩余溶液中的盐酸浓度,要防止锰离子出现沉淀,所以滴定终点的pH值要小于6.8,所以要用甲基橙做指示剂,根据氢氧化钠的物质的量可计算出V2mL剰余溶液中氯化氢的物质的量,进而可计算出此时溶液中氯化氢的物质的量浓度。
⑴装置甲中用MnO2和浓盐酸在加热条件下制取氯气,反应的离子方程式为MnO2 + 4H+ + 2Cl-![]() Mn2+ + Cl2↑ + 2H2O,根据上面的分析可知,整个制备装置中有一处不足,改进的方法是甲与乙之间连一个盛有饱和食盐水的洗气瓶;故答案为:MnO2 + 4H++2Cl-
Mn2+ + Cl2↑ + 2H2O,根据上面的分析可知,整个制备装置中有一处不足,改进的方法是甲与乙之间连一个盛有饱和食盐水的洗气瓶;故答案为:MnO2 + 4H++2Cl-![]() Mn2+ + Cl2↑ + 2H2O;甲与乙之间连一个盛有饱和食盐水的洗气瓶。
Mn2+ + Cl2↑ + 2H2O;甲与乙之间连一个盛有饱和食盐水的洗气瓶。
⑵由于SnCl4易水解,在实验过程中要将装置中的空气全部排尽,所以在实验时,首先加热的是甲处的烧瓶,根据上面的分析可知,冷凝管x是直形冷凝管,该仪器的编号是①,装置戊的用途是防止空气中水份进入丁装置,同时可以吸收氯气尾气;故答案为:甲;①;防止空气中水份进入丁装置,同时可以吸收氯气尾气。
⑶实验过程中装置甲中除观察到固体溶解外,还可观察到的明显变化是有黄绿色气体生成;故答案为:有黄绿色气体生成。
⑷①利用标准NaOH溶液滴定甲中剩余溶液中的盐酸浓度,要防止锰离子出现沉淀,所以滴定终点的pH值要小于6.8,所以要用甲基橙做指示剂;故答案为:甲基橙。
②根据题意,NaOH的物质的量为0.1000molL-1×V1×10-3L,所以V2 mL剰余溶液中氯化氢的物质的量为0.1000molL-1×V1×10-3L,则盐酸浓度为![]() ,所以盐酸与MnO2反应时最低浓度应大于
,所以盐酸与MnO2反应时最低浓度应大于![]() ;故答案为:
;故答案为:![]() 。
。

【题目】下列有关实验操作、现象、解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 充分吸收了Na2SiO3 饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3 可作防火剂 |
B | 将 H2 在充满Cl2 的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2 化合生成HCl |
C | 将 SO2 通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2 具有氧化性 |
D | 除去表面氧化膜的铝箔,在酒精灯上充分加热 | 铝不能滴落下来 | 铝熔点高,没能熔化 |
A.AB.BC.CD.D