题目内容
【题目】某空间站中宇航员的呼吸保障系统原理如图所示。
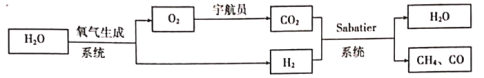
Sabatier系统中发生反应为:
反应I:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H1
CH4(g)+2H2O(g)△H1
反应II:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2=+41.2kJ/mol
CO(g)+H2O(g)△H2=+41.2kJ/mol
(1)常温常压下,已知:
①H2和CH4的燃烧热(△H)分别为-285.5kJ·mol-1和-890.0kJ·mol-1;
②H2O(l)=H2O(g)△H3=+44.0kJ·mol-1。则△H1=__________kJ·mol-1。
(2)按![]() =4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:
=4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:
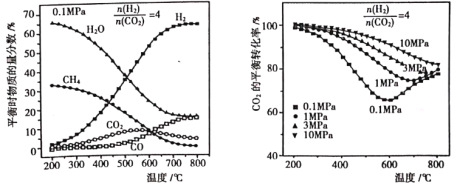
①Sabatier系统中应选择适宜的温度是__________。
②200~550℃时,CO2的物质的量分数随温度升高而增大的原因是__________。
③当温度一定时,随压强升高,CO2的平衡转化率增大,其原因是__________。
(3)一种新的循环利用方案是用Bosch反应[CO2(g)+2H2(g)![]() C(s)+2H2O(g)]代替Sabatier系统。
C(s)+2H2O(g)]代替Sabatier系统。
①分析Bosch反应的熵值变化为:△S__________0(选填“>”或“<”)。
②温度一定时,在2L密闭容器中按![]() =2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为__________(用含p0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
=2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为__________(用含p0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施能提高Bosch反应中CO2转化率的是_________(填标号)。
A.加快反应器中气体的流速B.提高原料气中CO2所占比例
C.增大催化剂的表面积D.反应器前段加热,后段冷却
【答案】-164.0 200℃ △H1<0、△H2>0,温度升高时,反应I向左移动CO2增加的量比反应II向右移动CO2减少的量多 反应II增压平衡不移动,反应I增压平衡向右移动,故CO2的平衡转化率增大 < ![]() D
D
【解析】
(1)已知:H2和CH4的燃烧热(△H)分别为-285.5kJ·mol-1和-890.0kJ·mol-1;H2O(l)=H2O(g)△H3=+44.0kJ·mol-1,根据盖斯定律计算解答;
(2)①产物的物质的量分数越大,反应物的转化率越高,该条件下温度最适宜;
②反应I△H1<0、反应Ⅱ△H2>0,恒压条件下,结合升高温度对反应Ⅱ、反应I的影响分析解答;
③相同温度下,反应II正向是前后气体分子数不变,压强改变不影响其平衡移动,反应I正向为气体分子数缩小的反应,增大压强,反应I的平衡向正反应方向移动,CO转化率增大;
(3)①由Bosch反应为CO2(g)+2H2(g)![]() C(s)+2H2O(g),为气体分子数目减少的体系,即平衡体系混乱度减小;
C(s)+2H2O(g),为气体分子数目减少的体系,即平衡体系混乱度减小;
②已知温度一定时,在2L密闭容器中按![]() =2,设氢气与二氧化碳初始投料分别为2mol和1mol,根据物质的量之比等于压强之比,列三段式计算解答;
=2,设氢气与二氧化碳初始投料分别为2mol和1mol,根据物质的量之比等于压强之比,列三段式计算解答;
③改变条件能使平衡正向移动但不能是通过增大二氧化碳浓度实现的都能提高二氧化碳转化率。
(1)已知:H2和CH4的燃烧热分别为285.5kJmol1和890.0kJmol1,可知热化学方程式:
a.H2(g)+![]() O2(g)=H2O(1)△H=285.5kJmol1,
O2(g)=H2O(1)△H=285.5kJmol1,
b.CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=890.0kJmol1,
c.H2O(1)═H2O(g)△H3=44.0kJmol1,根据盖斯定律,4a+2cb得,CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H1=164.0kJmol1;
CH4(g)+2H2O(g)△H1=164.0kJmol1;
(2)①产物的物质的量分数越大,反应物的转化率越高,Sabatier系统中CO2和H2为反应物,H2O、CH4、CO为产物,由图所示,200℃时CO2转化率最高,H2O、CH4的物质的量分数最大,Sabatier系统中应选择适宜的温度200℃;
②反应I△H1<0、反应Ⅱ△H2>0,恒压条件下,升高温度时反应I的平衡向逆向移动使CO2的量增加,反应II的平衡正向移动使CO2的量减少,但反应Ⅰ向左移动增加的CO2的量大于反应Ⅱ向右移动减少的CO2的量,所以CO2的物质的量分数随温度升高而增大;
③相同温度下,反应II正向是前后气体分子数不变,反应I正向为气体分子数缩小的反应,压强改变不影响其平衡移动,反应I正向为气体分子数缩小的反应,增大压强,反应I的平衡向正反应方向移动、反应II的平衡,所以相同温度时,压强越大,CO2的平衡转化率越大;
(3)①Bosch反应为CO2(g)+2H2(g)![]() C(s)+2H2O(g),由反应可知正反应为气体分子数目减少的体系,平衡体系混乱度减小,则△S<0;
C(s)+2H2O(g),由反应可知正反应为气体分子数目减少的体系,平衡体系混乱度减小,则△S<0;
②温度一定时,在2L密闭容器中按![]() =2投料进行Bosch反应,设设氢气与二氧化碳初始投料分别为2mol和1mol,二氧化碳的转化物质的量为xmol,列三段式:
=2投料进行Bosch反应,设设氢气与二氧化碳初始投料分别为2mol和1mol,二氧化碳的转化物质的量为xmol,列三段式:
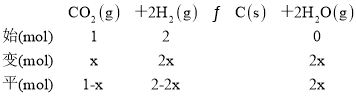
达到平衡时体系的压强为原来压强p0的0.7倍,即![]() ,解得x=0.9,则平衡时体系中CO2、H2、2H2O(g)的物质的量分别为0.1mol、0.2mol、1.8mol,混合气体的总物质的量=0.1+0.2+1.8=2.1mol,p(CO2)=
,解得x=0.9,则平衡时体系中CO2、H2、2H2O(g)的物质的量分别为0.1mol、0.2mol、1.8mol,混合气体的总物质的量=0.1+0.2+1.8=2.1mol,p(CO2)=![]() =
=![]() ,p(H2)=
,p(H2)=![]() =
=![]() ,p(H2O)=
,p(H2O)=![]() =0.6p0,该温度下反应平衡常数Kp=
=0.6p0,该温度下反应平衡常数Kp=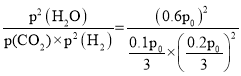 =
=![]() ;
;
③A.加快反应器中气体的流速,相当于减小浓度,平衡逆向移动,二氧化碳转化率减小,故A不符合题意;
B.提高原料气中CO2所占比例,平衡正向移动,但二氧化碳转化率减小,故B不符合题意;
C.增大催化剂的表面积,反应速率加快,但平衡不移动,二氧化碳转化率不变,故C不符合题意;
D.反应器前段加热,后段冷却,平衡正向移动,二氧化碳转化率增大,故D符合题意;
答案选D。

 阅读快车系列答案
阅读快车系列答案