题目内容
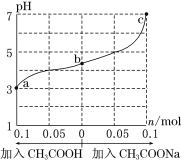
【题目】某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作。步骤如下:
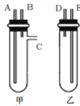
①将锌粒放于______(填“甲”或“乙”,下同)装置中,将稀硫酸放于______装置中。
②用橡胶管连接对应接口(填编号):A接______,B接______。
③将盛稀硫酸的试管倒置,即可发生反应放出气体。
【答案】甲 乙 D E
【解析】
Zn与稀硫酸为不加热固液反应装置,用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作,Zn在甲中,乙中为稀硫酸,A与D连,B与E连,倒置乙装置,即可生成氢气从C口逸出。
①将锌粒放于甲装置中,将稀硫酸放于乙装置中,将盛稀硫酸的试管倒置,即可发生反应放出气体;
②乙中短导管与A相连易于硫酸流下,用橡胶管连接对应接口为:A接D,B接E。

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
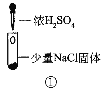
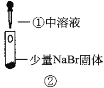
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟。 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝。 | 溶液变深紫色;经检验溶液含单质碘。 |
下列对实验的分析合理的是
A.实验1中,白烟是(NH4)2SO4
B.根据实验1和实验2判断还原性:Br->Cl-
C.根据实验3判断还原性:I->Br-
D.上述实验利用了浓H2SO4的强酸性、强氧化性等性质