题目内容
【题目】纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈__________色。
(2)实验室中需0.2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是__________。
A.1000mL;21.2g B.950mL;20.14g C.500mL;21.2g D.500mL;10.6g
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为______。
(4)某同学为确定一包可能由碳酸钠和碳酸氢钠组成的白色混合物的成分,他取少量该白色物质溶于水,并向所得溶液中加入适量澄清石灰水,产生白色沉淀,据此该同学认为有碳酸钠。你是否同意该同学的观点,请你用适当的化学方程式阐述你的观点________。
(5)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:

①曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为_______mL。
②曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________,其物质的量之比为________。
【答案】黄 A 32.8% 不同意,由于Ca(OH)2 + 2NaHCO3 = CaCO3↓ + Na2CO3 +2H2O (或Ca(OH)2 + NaHCO3 = CaCO3 ↓+ NaOH +H2O),碳酸氢钠溶液与石灰水反应也能产生白色沉淀 33.6 Na2CO3 与 NaHCO3 1:1
【解析】
(1)考查焰色反应;
(2)根据n=cV,m=nM计算;
(3)根据碳酸氢钠加热分解生成碳酸钠,二氧化碳和水,固体质量的减少即为生成二氧化碳的水的质量;
(4)根据碳酸钠,碳酸氢钠与氢氧化钙的反应判断;
(5)①根据碳原子守恒计算二氧化碳的物质的量即为碳酸氢钠的物质的量,利用n=![]() ;②由曲线B可知从25mL到75mL为碳酸氢钠与盐酸反应生成二氧化碳,根据钠原子守恒计算;
;②由曲线B可知从25mL到75mL为碳酸氢钠与盐酸反应生成二氧化碳,根据钠原子守恒计算;
(1)钠的焰色反应为黄色;
(2)配置950ml的溶液应用1000 mL容量瓶配制溶液,所需Na2CO3的质量m=nM=cVM=0.2mol/L×1L×106g/mol=21.2g,答案选A;
(3)设参加反应的碳酸氢钠的质量为x根据混合物质量减少了2.48g,
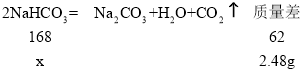
![]() ,解得x=6.72g,碳酸钠和碳酸氢钠共10g,则碳酸钠的质量为10g-6.72g= 3.28g,原混合物中碳酸钠的质量分数=
,解得x=6.72g,碳酸钠和碳酸氢钠共10g,则碳酸钠的质量为10g-6.72g= 3.28g,原混合物中碳酸钠的质量分数=![]() =32.8%;
=32.8%;
(4) 由于Ca(OH)2 + 2NaHCO3 = CaCO3↓ + Na2CO3 +2H2O (或Ca(OH)2 + NaHCO3 = CaCO3 ↓+ NaOH +H2O),碳酸钠与氢氧化钙反应会生成碳酸钙沉淀,同样碳酸氢钠与氢氧化钙反应也会生成碳酸钙沉淀,所以不同意他的观点;
(5) ①CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H2O,
当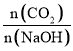 1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成NaHCO3,CO2有剩余;
1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成NaHCO3,CO2有剩余;
当![]() <
<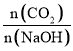 <1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当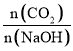
![]() ,反应按②进行,等于
,反应按②进行,等于![]() 时,CO2、NaOH恰好反应生成Na2CO3;小于
时,CO2、NaOH恰好反应生成Na2CO3;小于![]() 时,生成Na2CO3,NaOH有剩余;
时,生成Na2CO3,NaOH有剩余;
由曲线A可知从60ml到75ml为碳酸氢钠与盐酸反应, 消耗的15mL盐酸为碳酸氢钠与盐酸反应并产生CO2,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,所以n(NaHCO3)=n(HCl)=(75ml60ml)×0.1mol/L=1.5×103mol,根据C原子守恒,所以n(CO2)=n(NaHCO3)=1.5×103mol,V= nVm=1.5×103mol×22.4L/mol=33.6 mL;
② 加入75ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液。根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.075ml×0.1mol/L=0.0075mol,由曲线B/span>可知从25mL到75mL为碳酸氢钠与盐酸反应生成二氧化碳,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,所以n(NaHCO3)=n(HCl)= n(CO2)=(75ml25ml)×0.1mol/L=0.005mol,所以n(CO2):n(NaOH)=0.005mol:0.0075mol=![]() ,大于1:2,小于1,所以反应按①②进行,CO2、NaOH反应,NaOH无剩余,生成物为Na2CO3 与NaHCO3,根据钠原子守恒,所以
,大于1:2,小于1,所以反应按①②进行,CO2、NaOH反应,NaOH无剩余,生成物为Na2CO3 与NaHCO3,根据钠原子守恒,所以![]() n(Na2CO3)+n(NaHCO3)=0.0075mol,而n(NaHCO3)= 0.005mol,则n(NaHCO3)=0.005mol,故Na2CO3 与NaHCO3的物质的量之比为1:1。
n(Na2CO3)+n(NaHCO3)=0.0075mol,而n(NaHCO3)= 0.005mol,则n(NaHCO3)=0.005mol,故Na2CO3 与NaHCO3的物质的量之比为1:1。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案【题目】下列实验中的颜色变化,与氧化还原反应无关的是( )
选项 | 实验操作 | 现象 |
A | AgNO3溶液滴入氯水中 | 产生白色沉淀,随后淡黄绿色逐渐褪去 |
B | FeCl3溶液滴入Mg(OH)2浊液中 | 白色浑浊转化为红褐色沉淀 |
C | H2C2O4溶液滴入KMnO4酸性溶液中 | 产生气泡,随后紫色褪去 |
D | Na块放在坩埚里并加热 | 发出黄色火焰,生成淡黄色固体 |
A.AB.BC.CD.D
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。

(实验一)碘含量的测定。取0.0100mol/L的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
回答下列问题:
(1)实验中“灼烧”是在__(填仪器名称)中完成的。
(2)用文字具体描述“定容”过程:__
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为__mL,计算得海带中碘的质量百分含量为__%。
(实验二)碘的制取。另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(4)“适量O2”中能代替O2的最佳物质对应的电子式为__
(5)若要测定“I2+水溶液”中碘的含量,可以选择__作指示剂,用Na2S2O3溶液滴定,滴定终点的现象是__。
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为__(用离子方程式表示)。