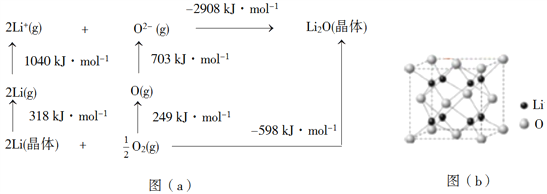
题目内容
【题目】一定条件下,密闭容器中的H2在催化剂的催化下可高效转化酸性溶液中的硝态氮(![]() )以达到消除污染的目的。其工作原理的示意图如图:
)以达到消除污染的目的。其工作原理的示意图如图:
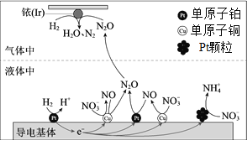
下列说法正确的是
A.导电基体上的正极产物仅有NO和![]()
B.若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
C.若导电基体上只有单原子铜,![]() 能全部转化为N2O
能全部转化为N2O
D.若Ir的表面处理1molN2O,理论上负极消耗89.6LH2
【答案】B
【解析】
由示意图可知,导电基体上H2在单原子铂表面转化为H+,发生氧化反应,为负极,![]() 部分在铂颗粒表面转化为
部分在铂颗粒表面转化为![]() ,部分在单原子铜表面转化为NO,NO又在单原子铂表面转化为N2O,发生还原反应,为正极;Ir的表面氢气和N2O发生反应生成N2和H2O,结合氧化还原反应的规律分析解答。
,部分在单原子铜表面转化为NO,NO又在单原子铂表面转化为N2O,发生还原反应,为正极;Ir的表面氢气和N2O发生反应生成N2和H2O,结合氧化还原反应的规律分析解答。
A.由示意图可知,导电基体上H2在单原子铂表面转化为H+,为负极,![]() 部分在铂颗粒表面转化为
部分在铂颗粒表面转化为![]() ,部分在单原子铜表面转化为NO,NO又在单原子铂表面转化为N2O,为正极,因此正极产物有NO、N2O和
,部分在单原子铜表面转化为NO,NO又在单原子铂表面转化为N2O,为正极,因此正极产物有NO、N2O和![]() ,故A错误;
,故A错误;
B.由示意图可知,导电基体上![]() 部分在铂颗粒表面转化为
部分在铂颗粒表面转化为![]() ,若导电基体上的Pt颗粒增多,则
,若导电基体上的Pt颗粒增多,则![]() 会更多的转化成铵根,将不利于降低溶液中的含氮量,故B正确;
会更多的转化成铵根,将不利于降低溶液中的含氮量,故B正确;
C.由示意图可知,导电基体上![]() 在单原子铜表面转化为NO,NO又在单原子铂和铜表面转化为N2O,若导电基体上只有单原子铜,
在单原子铜表面转化为NO,NO又在单原子铂和铜表面转化为N2O,若导电基体上只有单原子铜,![]() 将不能全部转化为N2O,故C错误;
将不能全部转化为N2O,故C错误;
D.由原理的示意图可知,Ir的表面氢气和N2O发生反应生成N2和H2O,若Ir的表面处理1molN2O,转移2mol电子,理论上负极消耗1mol氢气,未告知温度和压强,无法计算氢气的体积,故D错误;
故选B。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】下列实验中的颜色变化,与氧化还原反应无关的是( )
选项 | 实验操作 | 现象 |
A | AgNO3溶液滴入氯水中 | 产生白色沉淀,随后淡黄绿色逐渐褪去 |
B | FeCl3溶液滴入Mg(OH)2浊液中 | 白色浑浊转化为红褐色沉淀 |
C | H2C2O4溶液滴入KMnO4酸性溶液中 | 产生气泡,随后紫色褪去 |
D | Na块放在坩埚里并加热 | 发出黄色火焰,生成淡黄色固体 |
A.AB.BC.CD.D
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。

(实验一)碘含量的测定。取0.0100mol/L的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
回答下列问题:
(1)实验中“灼烧”是在__(填仪器名称)中完成的。
(2)用文字具体描述“定容”过程:__
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为__mL,计算得海带中碘的质量百分含量为__%。
(实验二)碘的制取。另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(4)“适量O2”中能代替O2的最佳物质对应的电子式为__
(5)若要测定“I2+水溶液”中碘的含量,可以选择__作指示剂,用Na2S2O3溶液滴定,滴定终点的现象是__。
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为__(用离子方程式表示)。
【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 共用三对电子形成双原子分子,常温下为气体单质 |
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物