题目内容
【题目】某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
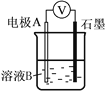
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
【答案】2H+ + 2e-=H2↑ 在金属活动性顺序中,Cu在H后,Cu不能置换出H2 O2 + 4H+ + 4e-=2H2O O2浓度越大,其氧化性越强,使电压值增大 溶液的酸碱性 排除溶液中的Na+(或SO42-)对实验的可能干扰;
【解析】
(1)①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,即为溶液中的H+得电子生成H2,其正极反应式是2H+ + 2e-=H2↑。
②针对实验Ⅱ现象,甲同学考虑到:在金属活动顺序表中,Cu排在H的后面,所以他认为不可能发生析氢腐蚀。乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极是溶解在溶液中的O2得电子,电极反应式是O2 + 4H+ + 4e-=2H2O。
(2)①丙同学比较实验Ⅱ、Ⅲ、Ⅳ,同样是pH=2的H2SO4溶液,只是溶解的O2量不同,导致电压表读数为:c>a>b,因此可以看出,氧气浓度越大,导电能力越强。
②丁同学对Ⅳ、Ⅴ进行比较,其变量是溶液pH的不同,因此其目的是探究溶液的酸碱性对O2氧化性的影响。实验Ⅳ中加入Na2SO4溶液,结果溶液的导电能力未变,从而说明溶液中的Na+(或SO42-)对实验不产生干扰,也由此得出实验Ⅳ中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案