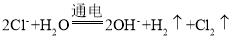题目内容
【题目】A、B、C、D为石墨电极,E、F分别为短周期相邻的两种活泼金属中的一种,且E能与NaOH溶液反应。按图接通线路,反应一段时间,当电路中通过1.0×10-3mol电子时,下列叙述正确的是( )
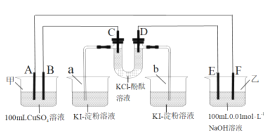
A.U型管中的D端先变红,b烧杯中的溶液会变蓝
B.a烧杯中最多有0.127gI2(KI足量)生成,甲池中的质量会减少0.04g(CuSO4溶液足量)
C.A极产生气体的体积为5.6mL,甲池溶液的pH值为2
D.E电极附近的溶液无明显现象产生
【答案】B
【解析】
A、B、C、D为石墨电极,E、F分别为短周期相邻的两种活泼金属中的一种,且E能与NaOH溶液反应,E为Al,F为Mg。乙池为原电池装置,E为负极、F为正极,A为阳极、B为阴极、C为阳极、D为阴极。
A.由分析可知,D为阴极,电极反应式为2H2O+2e-=2OH-+H2↑,故U型管中的D端先变红,但是,b烧杯中的溶液不会变蓝,A错误;
B.C为阳极,其电极反应式为2Cl--2e-=Cl2↑,该电路为串联电路,当电路中通过1.0×10-3mol电子时,n(Cl2)=5.0×10-4mol,a烧杯中发生的反应方程式为2I-+Cl2=2Cl-+I2,a烧杯中最多生成I2的物质的量为5.0×10-4mol,最多生成I2的质量为5.0×10-4mol×254g/mol=0.127g,甲池中A为阳极,电极反应式为2Cu2++2e-=2Cu,B为阴极,其电极反应式为2H2O-4e-=4H++O2↑,当电路中通过1.0×10-3mol电子时,n(Cu)=5.0×10-4mol,n(O2)=2.5×10-4mol,甲池中的质量会减少:5.0×10-4mol×64g/mol+2.5×10-4mol×32g/mol=0.04g,B正确;
C.A为阳极,产生的气体为O2,但是题中没有说明气体所处的状态,无法计算出气体的体积,C错误;
D.E为负极,E电极溶解,D错误;
答案选B。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
【题目】下列“实验结论”与“实验操作及现象”不相符的一组是
选项 | 试管实验操作及现象 | 实验结论 |
A | 向KI—淀粉溶液中滴加氯水,溶液变成蓝色 | 氧化性:I2>Cl2 |
B | 向蔗糖中滴加浓硫酸,蔗糖变黑 | 浓硫酸有脱水性 |
C | 向某溶液中加入盐酸无现象,再加入BaCl2溶液,有白色沉淀生成 | 溶液中含有 |
D | 向某盐溶液中加入浓氢氧化钠并加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝 | 溶液中含有 |
A.AB.BC.CD.D