题目内容
【题目】(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。如果采用NaClO、Ca(ClO)2作吸收剂,能得到较好的烟气脱硫效果。已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq) ΔH2
CaSO4(s)=Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=_____。
(2)将0.1 mol MnO2粉末加入到50 mL过氧化氢溶液(H2O2,ρ=1.1 g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示。
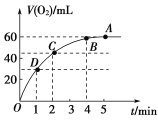
①实验时放出气体的总体积是________。
②放出一半气体所需的时间为______。
③反应放出![]() 体积气体所需的时间约为_______。
体积气体所需的时间约为_______。
④A,B,C,D各点反应速率的快慢顺序为______。
⑤解释反应速率变化的原因:_______。
⑥H2O2初始状态的浓度为________。
【答案】ΔH1+ΔH2-ΔH3 60 mL 1min 2min D>C>B>A 随着反应的进行,H2O2的浓度减小,反应速率减小 0.11 mol/L
【解析】
(1)结合盖斯定律可知,①+②-③得到SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)═CaSO4(s)+H2O(l)+Cl-(aq),以此来解答;
(2)①反应方程式为:2H2O2![]() 2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积;
2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积;
②反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
③反应放出气体体积为气体总体积的![]() 时,生成的气体体积为45mL,根据图象判断反应时间;
时,生成的气体体积为45mL,根据图象判断反应时间;
④根据浓度对反应速率的影响判断A、B、C、D各点反应速率大小;
⑤随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小;
⑥在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积,根据方程式计算过氧化氢浓度。
(1)由①SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l)ΔH1
②ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq)ΔH2
③CaSO4(s)=Ca2+(aq)+SO42-(aq)ΔH3
结合盖斯定律可知,①+②③得到SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq),△H=△H1+△H2△H3;
(2)①由反应方程式为:2H2O2![]() 2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL;
2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL;
②由图象可知,当时间进行到1min时,生成氧气的体积为30mL,此时生成的氧气为总体积的一半,需要的时间为1min;
③生成的总体积为60mL,反应放出气体体积为气体总体积的![]() 时,生成的氧气体积为45mL,由图象可知,需要的时间为2min;
时,生成的氧气体积为45mL,由图象可知,需要的时间为2min;
④反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,A、B、C、D各点反应速率的快慢顺序为D>C>B>A;
⑤浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;
⑥由反应方程式为:2H2O2![]() 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL=0.06L,
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL=0.06L,
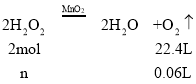
n=![]() =0.00536mol,所以c(H2O2)=
=0.00536mol,所以c(H2O2)=![]() =0.11 mol/L。
=0.11 mol/L。

 名校课堂系列答案
名校课堂系列答案【题目】某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
【题目】为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g Ag2SO4:0.796 g
(1)甲同学的实验如下:
序号 | 操作 | 现象 |
实验Ⅰ | 将2 mL 1 mol/L AgNO3溶液加入到1 mL 1 mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
取上层清液,滴加KSCN 溶液 | 溶液变红 |
注:经检验黑色固体为Ag
① 白色沉淀的化学式是_____________。
② 甲同学得出Ag+氧化了Fe2+的依据是_______________。
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
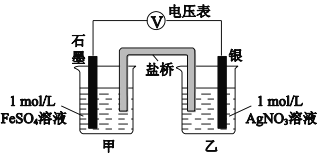
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① a中甲烧杯里的电极反应式是___________。
② b中电压表指针逆向偏移后,银为_________极(填“正”或“负”)。
③ 由实验得出Ag+和Fe2+反应的离子方程式是___________。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
序号 | 操作 | 现象 |
实验Ⅲ | 将2 mL 2 mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
实验Ⅳ | 将2 mL1 mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
实验Ⅴ | 将2 mL 2 mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
① 实验Ⅲ___________(填“能”或“不能”)证明Fe3+氧化了Ag,理由是_____________。
② 用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:_____________。