题目内容
15.丙烯酸乙酯(Ⅳ)是合成塑料、树脂等高聚物的重要中间体,可由下面路线合成:CH2=CH-CHO$→_{反应①}^{CrO_{3}}$CH2=CH-COOH$→_{反应②}^{SOCl_{2}}$
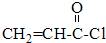 $→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3
$→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3ⅠⅡⅢⅣ
(1)反应②属于取代反应,1molⅣ完全燃烧消耗O2为6mol.
(2)Ⅱ含有的官能团名称为碳碳双键和羧基,Ⅱ能使溴水褪色,其反应方程式为CH2=CHCOOH+Br2→CH2BrCHBrCOOH.
(3)Ⅰ可以由Ⅴ(分子式为C3H6O)催化氧化得到,则Ⅴ→Ⅰ的反应方程式为
 .(注明反应条件)
.(注明反应条件)(4)Ⅵ是Ⅳ的一种无支链的同分异构体,且碳链两端呈对称结构.则Ⅵ的结构简式为OHCCH2CH2CH2CHO或
 或CH2=CH-O-CH2-O-CH=CH2.
或CH2=CH-O-CH2-O-CH=CH2.(5)一定条件下,化合物
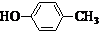 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为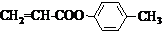 .
.
分析 (1)比较CH2=CH-COOH和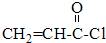 的结构可知反应②的反应类型,根据化合物Ⅳ的结构简式可得分子式,写出反应的方程式可得耗氧量;
的结构可知反应②的反应类型,根据化合物Ⅳ的结构简式可得分子式,写出反应的方程式可得耗氧量;
(2)化合物II中的官能团有碳碳双键和羧基,其中碳碳双键与溴可以发生加成反应;
(3)比较Ⅱ和Ⅲ结构可知反应类型;醇催化氧化成醛,结合Ⅴ的分子式和Ⅰ的结构简式,可知Ⅴ为烯醇,由此可写出醇氧化成醛的方程式;
(4)根据CH2=CH-COOCH2CH3的结构可知,Ⅳ的不饱和度为2,Ⅵ是Ⅳ的一种无支链的同分异构体,且碳链两端呈对称结构,所以Ⅵ中应有两个碳碳双键或碳氧双键;(5)反应③原理是结构中氯原子被醇中烷氧基取代,类比写出化合物Ⅲ与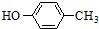 反应的产物.
反应的产物.
解答 解:(1)比较CH2=CH-COOH和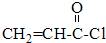 的结构可知反应②的反应类型为取代反应,根据烃的含氧衍生物燃烧通式可得:C5H8O2+6O2 $\stackrel{点燃}{→}$5CO2+4H2O,其中氧气与Ⅳ的物质的量之比等于系数之比,则1molⅣ完全燃烧最少需要消耗6mol O2,
的结构可知反应②的反应类型为取代反应,根据烃的含氧衍生物燃烧通式可得:C5H8O2+6O2 $\stackrel{点燃}{→}$5CO2+4H2O,其中氧气与Ⅳ的物质的量之比等于系数之比,则1molⅣ完全燃烧最少需要消耗6mol O2,
故答案为:取代;6;
(2)化合物II中的官能团有碳碳双键和羧基,其中碳碳双键与溴可以发生加成反应,反应方程式为:CH2=CHCOOH+Br2→CH2BrCHBrCOOH;
故答案为:碳碳双键和羧基;CH2=CHCOOH+Br2→CH2BrCHBrCOOH;
(3)比较Ⅱ和Ⅲ结构可知:化合物Ⅱ中-COOH经过反应②变成了化合物Ⅲ中-COCl,氯原子取代了羟基位置,故反应②为取代反应;醇催化氧化成醛,结合Ⅴ的分子式和Ⅰ的结构简式,可知Ⅴ为烯醇,结构简式为:CH2=CH-CH2OH,由此可写出醇氧化成醛的方程式: ;
;
故答案为:取代; ;
;
(4)根据CH2=CH-COOCH2CH3的结构可知,Ⅳ的不饱和度为2,Ⅵ是Ⅳ的一种无支链的同分异构体,且碳链两端呈对称结构,所以Ⅵ中应有两个碳碳双键或碳氧双键,所以Ⅵ的结构简式为OHCCH2CH2CH2CHO 或 或CH2=CH-O-CH2-O-CH=CH2,
或CH2=CH-O-CH2-O-CH=CH2,
故答案为:OHCCH2CH2CH2CHO 或 或CH2=CH-O-CH2-O-CH=CH2;
或CH2=CH-O-CH2-O-CH=CH2;
(5)反应③原理是结构中氯原子被醇中烷氧基取代,类比写出化合物Ⅲ与 反应的产物为:
反应的产物为: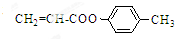 .
.
故答案为: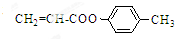 .
.
点评 本题以有机物的合成考查结构与性质,把握有机物典型代表物的组成和性质以及它们相互联系、重要有机反应类型如取代反应、加成反应、消去反应和氧化反应等为解答的关键,综合考查考生的分析能力、逻辑推理能力、综合应用信息以及信息迁移能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 氧化反应 |
| A. | 矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快 | |
| B. | 接触室中采用常压的主要原因是常压下SO2的转化率已经很高 | |
| C. | 沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒 | |
| D. | 接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量 |
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 3v逆(C)=2v正(B) | D. | 气体的平均相对分子质量 |
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
| E | E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
(2)E元素原子的核外电子排布式为1s22s22p63s23p63d 64s2;
(3)盐X的水溶液呈酸性(填“酸性”“碱性”或“中性”);
(4)C单质分子中σ键和π键的个数比为1:2,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是NH3分子间存在氢键;
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:
 ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+. (1)提出假设
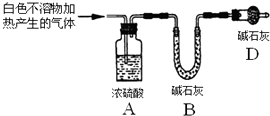
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红.
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为Mg(OH)2 .
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 氢气 |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤, 加入足量稀盐酸 | 产生气泡沉淀全部溶解 | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加 入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在④ CO32-离子 |
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验前后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .
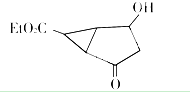
Et代表的基团为-CH2CH3
该有机分子的核磁共振波谱图如下(单位是ppm).
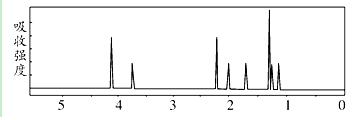
下列关于该有机物的叙述正确的是( )
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 该有机物分子式为C9H14 O4 | |
| D. | 1 mol该有机物完全燃烧可以产生7 mol水 |
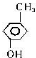 .
.